Byetta за лечение на диабет
Име на марката: Byetta
Родово име: Exenatide
Лекарствена форма: инжектиране
Съдържание:
описание
Клинична фармакология
Клинични изследвания
Показания и употреба
Противопоказания
предпазни мерки
Нежелани реакции
Предозирането
Дозировка и приложение
съхранение
Как се доставя
Информация за пациента на Byetta (Exenatide) (на обикновен английски)
описание
Byetta® (ексенатид) е синтетичен пептид, който има инкретин-миметични действия и първоначално е идентифициран в гущер Heloderma sumctum. Byetta усилва глюкозозависимата инсулинова секреция от бета-клетката на панкреаса, потиска неподходящо повишената глюкагонова секреция и забавя изпразването на стомаха. Есенатидът се различава по химична структура и фармакологично действие от инсулин, сулфонилуреи (включително D-фенилаланинови производни и меглитиниди), бигуаниди, тиазолидиндиони и алфа-глюкозидаза инхибитори.
Exenatide е амид на аминокиселината от 39 аминокиселини. Ексенатид има емпиричната формула С184Н282н50О60S и молекулно тегло от 4186,6 далтона. Аминокиселинната последователност за ексенатид е показана по-долу.
H - His - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Pro - Ser - NH2
Byetta се доставя за подкожно (SC) инжектиране като стерилен, запазен изотоничен разтвор в стъклена касета, която е сглобена в химикалка (химикалка). Всеки милилитър (mL) съдържа 250 микрограма (mcg) синтетичен ексенатид, 2,2 mg метакрезол като антимикробен консервант, манитол като средство за регулиране на тоничността и ледена оцетна киселина и натриев ацетат трихидрат във вода за инжектиране като буферен разтвор при pH 4,5. Предлагат се две предварително напълнени химикалки за доставяне на единични дози от 5 mcg или 10 mcg. Всяка предварително напълнена писалка ще даде 60 дози, за да осигури 30 дни на два пъти дневно приложение (BID).
Горна част
Клинична фармакология
Механизъм на действие
Инкретини, като глюкагоноподобен пептид-1 (GLP-1), засилват глюкозозависимата секреция на инсулин и проявяват други антихипергликемични действия след освобождаването им в кръвообращението от червата. Ексенатид е инкретинов миметичен агент, който имитира усилването на глюкозозависимата секреция на инсулин и няколко други антихипергликемични действия на инкретините.
Аминокиселинната последователност на ексенатид частично се припокрива с тази на човешкия GLP-1. Доказано е, че Exenatide свързва и активира известния човешки GLP-1 рецептор in vitro. Това води до увеличаване както на глюкозозависимия синтез на инсулин, така и in vivo секрецията на инсулин от бета клетки на панкреаса, чрез механизми, включващи циклична AMP и / или друга вътреклетъчна сигнализация пътища. Exenatide насърчава освобождаването на инсулин от бета клетки при наличие на повишени концентрации на глюкоза. Когато се прилага in vivo, екзенатид имитира някои антихипергликемични действия на GLP-1.
Byetta подобрява гликемичния контрол, като намалява концентрациите на глюкоза на гладно и постпрандиални при пациенти с диабет тип 2 чрез описаните по-долу действия.
Глюкоза-зависима секреция на инсулин: Байета има остър ефект върху реакцията на бета-клетки на панкреаса към глюкозата и води до освобождаване на инсулин само при наличие на повишени концентрации на глюкоза. Тази секреция на инсулин отшумява, тъй като концентрациите на глюкоза в кръвта намаляват и наближават еугликемия.
Първофазен отговор на инсулин: При здрави индивиди, здравата секреция на инсулин възниква през първите 10 минути след интравенозно (IV) приложение на глюкоза. Тази секреция, известна като "инсулинов отговор от първа фаза", характерно липсва при пациенти с диабет тип 2. Загубата на инсулиновия отговор в първата фаза е ранен бета-клетъчен дефект при диабет тип 2. Приложението на Byetta в терапевтични плазмени концентрации възстановява инсулиновия отговор от първа фаза на IV болус на глюкоза при пациенти с диабет тип 2 (Фигура 1). Както секрецията на инсулин от първа фаза, така и втората фаза на инсулин е значително повишена при пациенти с диабет тип 2, лекувани с Byetta, в сравнение с физиологичен разтвор (p
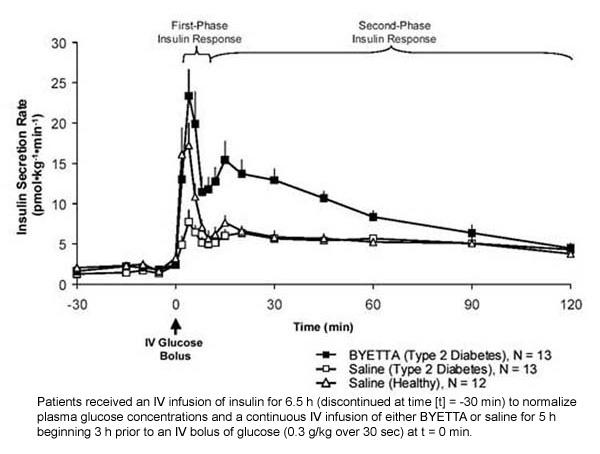
Фигура 1: Средна (+ SEM) скорост на секреция на инсулин по време на инфузия на байета или физиологичен разтвор при пациенти с диабет тип 2 и по време на инфузия на физиологичен разтвор при здрави субекти
Секреция на глюкагон: При пациенти с диабет тип 2, Byetta модерира глюкагоновата секреция и понижава серумните концентрации на глюкагон по време на периоди на хипергликемия. По-ниските концентрации на глюкагон водят до намаляване на чернодробната глюкоза и намаляване на консумацията на инсулин. Въпреки това, Байета не уврежда нормалния глюкагонов отговор на хипогликемия.
Стомашно изпразване: Байета забавя изпразването на стомаха, като по този начин намалява скоростта, с която глюкозата, получена от храненето, се появява в циркулацията.
Прием на храна: Както при животни, така и при хора, е показано, че прилагането на екзенатид намалява приема на храна.
Фармакокинетика
абсорбция
След прилагане на SC при пациенти с диабет тип 2, екзенатид достига средни пикови плазмени концентрации за 2,1 часа. Средна пикова концентрация на ексенатид (Смакс) беше 211 pg / mL и общата средна площ под кривата (AUC0-inf) беше 1036 pg-h / mL след прилагане на SC на 10 mcg доза от Byetta. Излагането на екзенатид (AUC) се увеличава пропорционално в диапазона на терапевтичната доза от 5 mcg до 10 mcg. Стойностите на Cmax нарастват по-малко, отколкото пропорционално в същия диапазон. Подобна експозиция се постига при прилагане на SC на Byetta в областта на корема, бедрото или ръката.
разпределение
Средният привиден обем на разпределение на ексенатид след прилагане на SC на единична доза Byetta е 28,3 L.
Метаболизъм и елиминиране
Неклиничните проучвания показват, че ексенатид се елиминира предимно чрез гломерулна филтрация с последващо протеолитично разграждане. Средният привиден клирънс на ексенатид при хора е 9,1 L / h, а средният терминален полуживот е 2,4 h. Тези фармакокинетични характеристики на екзенатид са независими от дозата. При повечето хора концентрациите на екзенатид са измерими за приблизително 10 часа след дозата.
Специални популации
Бъбречна недостатъчност
При пациенти с леко до умерено бъбречно увреждане (креатининов клирънс 30 до 80 ml / min), клирънсът на екзенатид е само леко намален; следователно, не се налага коригиране на дозата на Byetta при пациенти с леко до умерено бъбречно увреждане. Въпреки това, при пациенти с бъбречно заболяване в краен стадий, получаващи диализа, средният клирънс на екзенатид е намален до 0,9 L / h в сравнение с 9,1 L / h при здрави лица (вж. МЕРКИ, Общ).
Чернодробна недостатъчност
Не е провеждано фармакокинетично проучване при пациенти с диагноза остра или хронична чернодробна недостатъчност. Тъй като ексенатидът се изчиства основно от бъбреците, не се очаква чернодробната дисфункция да повлияе на концентрациите на екзенатид в кръвта (вж. Фармакокинетика, Метаболизъм и елиминиране).
Гериатрична
Популационният фармакокинетичен анализ на пациенти (варира от 22 до 73 години) предполага, че възрастта не влияе върху фармакокинетичните свойства на екзенатид.
Педиатрична
Exenatide не е проучван при педиатрични пациенти.
пол
Популационният фармакокинетичен анализ на мъже и жени показва, че полът не влияе върху разпределението и елиминирането на екзенатид.
раса
Популационният фармакокинетичен анализ на пациенти, включително кавказки, испаноядни и черни, предполага, че расата няма значително влияние върху фармакокинетиката на ексенатид.
прекалена пълнота
Популационният фармакокинетичен анализ на пациенти със затлъстяване (ИТМ ‰ kg 30 kg / m2) и пациенти без затлъстяване предполага, че затлъстяването няма значителен ефект върху фармакокинетиката на екзенатид.
Взаимодействия с лекарства
Дигоксин
Едновременното приложение на многократни дози Byetta (10 mcg BID) намалява Смакс перорален дигоксин (0,25 mg QD) със 17% и забавя Tmax с приблизително 2,5 h; въпреки това общата експозиция на фармакокинетиката в стационарно състояние (AUC) не е променена.
ловастатин
AUC и Cmax на ловастатин са намалени съответно с 40% и 28%, а Tmax се забави с около 4 часа, когато Byetta (10 mcg BID) се прилага едновременно с еднократна доза ловастатин (40 mg) в сравнение с прилагания ловастатин сам. В 30-седмичните контролирани клинични изпитвания на Byetta, употребата на Byetta при пациенти, които вече получават HMG CoA редуктазните инхибитори не са свързани с последователни промени в липидните профили в сравнение с изходно ниво.
Лизиноприл
При пациенти с лека до умерена хипертония, стабилизирана на лизиноприл (5 до 20 mg / ден), Byetta (10 mcg BID) не променя стационарно Cmax или AUC на лизиноприл. Стабилно състояние на лизиноприл Tмакс се забави с 2 часа. Няма промени в средното 24-часово систолно и диастолично кръвно налягане.
Парацетамолът
Когато 1000 mg ацетаминофен еликсир се дава с 10 mcg Byetta (0 h) и 1 h, 2 h и 4 h след инжектиране на Byetta, AUC на ацетаминофен намаляват съответно с 21%, 23%, 24% и 14%; ° Смакс е намален съответно с 37%, 56%, 54% и 41%; Tмакс се увеличава от 0,6 h през контролния период до 0,9 h, 4,2 h, 3,3 h и 1,6 h, съответно. Ацетаминофен AUC, Cмакс и Tmax не се променят значително, когато ацетаминофен се дава 1 час преди инжектирането на Byetta.
Варфарин
Едновременното приложение на повтарящи се дози Byetta (5 mcg BID на 1-2 и 10 mcg BID на 3-9 дни) при здрави доброволци, забавя варфарин (25 mg) Tmax с около 2 часа. Не са наблюдавани клинично значими ефекти върху Cmax или AUC на S- и R-енантиомери на варфарин. Byetta не променя фармакодинамичните свойства (както се оценява чрез INR отговор) на варфарин.
Фармакодинамика
Постпрандиална глюкоза
При пациенти с диабет тип 2, Byetta намалява постпрандиалните плазмени концентрации на глюкоза (Фигура 2).

Фигура 2: Средни (+ SEM) постпрандиални плазмени концентрации на глюкоза в ден 1 на Байетаа Лечение при пациенти с диабет тип 2, лекувани с метформин, сулфонилурея или и двете (N = 54)
Глюкоза на гладно
В едно кръстосано проучване с една доза при пациенти с диабет тип 2 и хипергликемия на гладно, незабавно освобождаване на инсулин последва инжектиране на Byetta. Плазмените концентрации на глюкоза са значително намалени с Byetta в сравнение с плацебо (Фигура 3).

Фигура 3: Средни (+ SEM) концентрации на серумен инсулин и плазмена глюкоза след еднократна инжекция на Byettaа или плацебо при пациенти на гладно с диабет тип 2 (N = 12)
Горна част
Клинични изследвания
Използвайте с метформин и / или сулфонилурея
Проведени са три 30-седмични двойно-слепи плацебо-контролирани проучвания за оценка на безопасността и ефикасността на Byetta при пациенти с тип 2 диабет, чийто гликемичен контрол е недостатъчен само с метформин, само сулфонилурея или метформин в комбинация с сулфонилурея.
Общо 1446 пациенти бяха рандомизирани в тези три проучвания: 991 (68,5%) бяха кавказки, 224 (15,5%) бяха испаноядни, а 174 (12,0%) бяха чернокожи. Средните стойности на HbA1c в началните стойности на изпитванията варираха от 8,2% до 8,7%. След 4-седмичен период на плацебо, пациентите са на случаен принцип да получават Byetta 5 mcg BID, Byetta 10 mcg BID или плацебо BID преди сутрешното и вечерното хранене, в допълнение към съществуващите перорални антидиабетици агент. Всички пациенти, назначени на Byetta, започват период на започване на лечението с 5 mcg BID в продължение на 4 седмици. След 4 седмици тези пациенти или продължават да получават Byetta 5 mcg BID, или дозата им се увеличава до 10 mcg BID. Пациентите, назначени на плацебо, получават плацебо BID през цялото проучване.
Основната крайна точка във всяко изследване е средна промяна от изходната стойност на HbA1в на 30 седмици. Резултатите от тридесетседмичното проучване са обобщени в таблица 1.
Таблица 1: Резултати от тридесетседмични плацебо-контролирани изпитвания на Byetta при пациенти с неадекватен контрол на глюкозата, въпреки употребата на метформин, сулфонилурея или и двете
| Плацебо ПРЕДЛОЖЕНИЕ |
Byetta 5 mcg BID |
Byetta 10 mcg* ПРЕДЛОЖЕНИЕ |
|
|---|---|---|---|
| |||
| В комбинация с метформин | |||
| Население за намерение за лечение (N) | 113 | 110 | 113 |
| HbA1в (%), Означава | |||
| Изходна | 8.2 | 8.3 | 8.2 |
| Промяна на 30 седмица | +0.1 | −0.4†| −0.8° С |
| Пропорция, постигаща HbA1в≤7% § | 13.0% | 31.6%†| 46.4%†|
| Тегло на тялото (kg), средно | |||
| Изходна | 99.9 | 100.0 | 100.9 |
| Промяна на 30 седмица | −0.3 | −1.6†| −2.8° С |
| В комбинация със сулфонилурея | |||
| Население за намерение за лечение (N) | 123 | 125 | 129 |
| HbA1в (%), Означава | |||
| Изходна | 8.7 | 8.5 | 8.6 |
| Промяна на 30 седмица | +0.1 | −0.5†| −0.9° С |
| Пропорция, постигаща HbA1в≤7% § | 8.8% | 32.6%†| 41.3%° С |
| Тегло на тялото (kg), средно | |||
| Изходна | 99.1 | 94.9 | 95.2 |
| Промяна на 30 седмица | −0.6 | −0.9 | −1.6†|
| В комбинация с метформин и сулфонилурея | |||
| Население за намерение за лечение (N) | 247 | 245 | 241 |
| HbA1в (%), Означава | |||
| Изходна | 8.5 | 8.5 | 8.5 |
| Промяна на 30 седмица | +0.2 | −0.6° С | −0.8° С |
| Пропорция, постигаща HbA1в≤7% § | 9.2% | 27.4%° С | 33.5%° С |
| Тегло на тялото (kg), средно | |||
| Изходна | 99.1 | 96.9 | 98.4 |
| Промяна на 30 седмица | −0.9 | −1.6†| −1.6†|
HbA1в
Добавянето на Byetta към схема на метформин, сулфонилурея или и двете, доведе до статистически значими намаления от изходната стойност на HbA1в на 30 седмица в сравнение с пациенти, получаващи плацебо, добавени към тези средства в трите контролирани проучвания (маса 1). В допълнение, се наблюдава статистически значим ефект на дозата между 5-mcg и 10-mcg Byetta групи за промяната от изходната стойност на HbA1в на седмица 30 в трите проучвания.
Гладна и постпрандиална глюкоза
Дългосрочната употреба на Byetta в комбинация с метформин, сулфонилурея или и двете, намалява както гладуването, така и постпрандиални плазмени концентрации на глюкоза по статистически значим начин, зависим от дозата през седмицата 30. Статистически значимо намаление от изходната стойност както при средните концентрации на глюкоза на гладно, така и след се наблюдава на 30-та седмица и в двете групи на Byetta в сравнение с плацебо в данни, комбинирани от трите контролирани изпитвания. Промяната в концентрацията на глюкоза на гладно на 30 седмица в сравнение с изходната стойност беше 8 mg / dL за Byetta 5 mcg BID и - 10 mg / dL за Byetta 10 mcg BID, в сравнение с +12 mg / dL за плацебо. Проведената промяна в 2-часовата концентрация на постпрандиална глюкоза след прилагане на Byetta на 30 седмица с базова стойност беше 63 mg / dL за 5 mcg BID и 71 mg / dL за 10 mcg BID, в сравнение с +11 mg / dL за плацебо.
Пропорция на пациентите, постигащи HbA1в≤7%
Byetta в комбинация с метформин, сулфонилурея или и двете, доведоха до по-голяма, статистически значима процент от пациентите, които постигат HbA1câ ¤ ¤7 на 30 седмица в сравнение с пациенти, получаващи плацебо в комбинация с тези агенти (маса 1).
Телесно тегло
В трите контролирани проучвания намаление от изходното телесно тегло на 30-та седмица е свързано с BETTA 10 mcg BID в сравнение с плацебо BID при пациенти с диабет тип 2 (маса 1).
Едногодишни клинични резултати
Кохортата от 163 пациенти от 30-седмичните плацебо-контролирани проучвания, завършили общо 52 седмици лечение с Byetta 10 mcg BID, има промени в HbA1c от изходната стойност от -1,0% и -1,1% на 30 и 52 седмици на лечение, съответно, с придружаващи промени от основната стойност на плазмената глюкоза на гладно - 14,0 mg / dL и - 25,3 mg / dL, и промените в телесното тегло - 2,6 kg и 3,6 килограма. Тази кохорта има изходни стойности, подобни на тези на цялата контролирана пробна популация.
Използвайте с тиазолидиндион
В рандомизирано, двойно-сляпо, плацебо-контролирано проучване с продължителност 16 седмици, Byetta (n = 121) или плацебо (n = 112) е добавен към съществуващото лечение с тиазолидиндион (пиоглитазон или розиглитазон), със или без метформин, при пациенти с диабет тип 2 с неадекватен гликемичен контрол. Рандомизацията на Byetta или плацебо е стратифицирана въз основа на това дали пациентите получават метформин. Пациентите, назначени на плацебо, получават плацебо BID през цялото проучване. Byetta или плацебо се инжектират подкожно преди хранене сутрин и вечер. Седемдесет и девет процента от пациентите са приемали тиазолидиндион и метформин, а 21% са приемали тиазолидиндион самостоятелно. По-голямата част от пациентите (84%) са били кавказки, 8% са испаноядни и 3% са черни. Средните базови стойности на HbA1c бяха сходни за Byetta и плацебо (7,9%). Лечението с Byetta е започнато с доза от 5 mcg BID за 4 седмици, след което се увеличава до 10 mcg BID за още 12 седмици.
Шестнадесетседмичните проучвания са обобщени в таблица 2. В сравнение с плацебо, Byetta доведе до статистически значимо намаление на HbA1c от изходното ниво на 16-та седмица. Ефектите от лечението за HbA1c бяха сходни в двете подгрупи, дефинирани от основния лечебен слой (самостоятелно тиазолидиндиони срещу тиазолидиндиони плюс метформин). Промяната в концентрацията на серумна глюкоза на гладно от изходната линия до 16-та седмица е статистически значима в сравнение с плацебо (ˆ 21 mg / dL за Byetta 10 mcg BID в сравнение с +4 mg / dL за плацебо).
Таблица 2: Резултати от 16-седмично плацебо-контролирано изпитване на Byetta при пациенти с неадекватен контрол на глюкозата, въпреки употребата на тиазолидиндион (TZD) или тиазолидиндион плюс метформин
| Плацебо ПРЕДЛОЖЕНИЕ |
Byetta 10 mcg* ПРЕДЛОЖЕНИЕ |
|
|---|---|---|
| ||
| В комбинация с TZD или TZD плюс MET | ||
| Население за намерение за лечение (N) | 112 | 121 |
| HbA1в (%), Означава | ||
| Изходна | 7.9 | 7.9 |
| Промяна на 16 седмица | +0.1 | −0.8†|
| Пропорция, постигаща HbA1в≤7%° С | 16.2% | 62.3%†|
| Тегло на тялото (kg), средно | ||
| Изходна | 96.9 | 97.5 |
| Промяна на 16 седмица | −0.2 | −1.5†|
Горна част
Показания и употреба
Byetta е показан като допълнителна терапия за подобряване на гликемичния контрол при пациенти със захарен диабет тип 2, които приемат метформин, сулфонилурея, тиазолидиндион, комбинация от метформин и сулфонилурея или комбинация от метформин и тиазолидиндион, но не са постигнали адекватна гликемична контрол.
Горна част
Противопоказания
Байета е противопоказан при пациенти с известна свръхчувствителност към екзенатид или към някой от компонентите на продукта.
Горна част
предпазни мерки
Общ
Byetta не е заместител на инсулина при пациенти, изискващи инсулин. Byetta не трябва да се използва при пациенти с диабет тип 1 или за лечение на диабетна кетоацидоза.
Пациентите могат да развият антиексенатидни антитела след лечение с Byetta, в съответствие с потенциално имуногенните свойства на протеинови и пептидни фармацевтични продукти. Пациентите, получаващи Byetta, трябва да бъдат наблюдавани за признаци и симптоми на реакции на свръхчувствителност.
При малка част от пациентите образуването на антиексенатидни антитела при високи титри може да доведе до невъзможност за постигане на адекватно подобрение на гликемичния контрол. Ако има влошаващ се гликемичен контрол или не е постигнат целенасочен гликемичен контрол, трябва да се обмисли алтернативна антидиабетна терапия.
Едновременната употреба на Byetta с инсулин, D-фенилаланинови производни, меглитиниди или алфа-глюкозидазни инхибитори не е проучена.
Byetta не се препоръчва за употреба при пациенти с бъбречно заболяване в краен стадий или тежко бъбречно увреждане (креатининов клирънс Фармакокинетика, специални популации). При пациенти с краен стадий на бъбречно заболяване, получаващи диализа, единичните дози Byetta 5 mcg не се понасят добре поради стомашно-чревни странични ефекти.
Има редки спонтанно съобщени събития с променена бъбречна функция, включително повишен серум креатинин, бъбречно увреждане, влошена хронична бъбречна недостатъчност и остра бъбречна недостатъчност, понякога изискваща хемодиализа. Някои от тези събития са възникнали при пациенти, получаващи едно или повече фармакологични средства, за които е известно, че влияят на бъбреците функция / хидратационен статус и / или при пациенти, които изпитват гадене, повръщане и / или диария, със или без обезводняване. Съпътстващите средства включват ангиотензин-конвертиращи ензимни инхибитори, нестероидни противовъзпалителни средства и диуретици. Наблюдава се обратимост на променената бъбречна функция при поддържащо лечение и прекратяване на потенциално причинители, включително екзенатид. Не е установено, че Exenatide е директно нефротоксичен в предклинични или клинични проучвания.
Byetta не е проучван при пациенти с тежко стомашно-чревно заболяване, включително гастропареза. Употребата му обикновено е свързана със стомашно-чревни нежелани ефекти, включително гадене, повръщане и диария. Следователно, употребата на Byetta не се препоръчва при пациенти с тежко стомашно-чревно заболяване. Развитието на силна коремна болка при пациент, лекуван с Byetta, трябва да се изследва, защото това може да е предупредителен знак за сериозно състояние.
Хипогликемията
В 30-седмичните контролирани клинични изпитвания с Byetta е регистриран епизод на хипогликемия като нежелано събитие, ако пациентът съобщава за симптоми, свързани с хипогликемия с придружаваща кръвна глюкоза ДОЗИРАНЕ И АДМИНИСТРАЦИЯ).
Таблица 3: Честота (%) на хипогликемия * от съпътстваща антидиабетна терапия
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Плацебо ПРЕДЛОЖЕНИЕ |
5 mcg ПРЕДЛОЖЕНИЕ |
10 mcg ПРЕДЛОЖЕНИЕ |
Плацебо ПРЕДЛОЖЕНИЕ |
5 mcg ПРЕДЛОЖЕНИЕ |
10 mcg ПРЕДЛОЖЕНИЕ |
Плацебо ПРЕДЛОЖЕНИЕ |
5 mcg ПРЕДЛОЖЕНИЕ |
10 mcg ПРЕДЛОЖЕНИЕ |
|
| С Метформин | Със сулфонилурея | С MET / SFU | |||||||
| Байета и плацебо са били прилагани преди сутрешното и вечерното хранене. | |||||||||
| Съкращения: BID, два пъти дневно; MET / SFU, метформин и сулфонилурея. | |||||||||
| |||||||||
| н | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| Хипогликемията | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Когато се използва като добавка към тиазолидиндион, със или без метформин, честотата на симптоматична лека до умерена хипогликемия при Byetta е 11% в сравнение със 7% при плацебо.
Byetta не променя противорегулаторните реакции на хормона към индуцирана от инсулин хипогликемия в рандомизирано, двойно сляпо, контролирано проучване при здрави индивиди.
Информация за пациенти
Пациентите трябва да бъдат информирани за потенциалните рискове от Byetta. Пациентите също трябва да бъдат напълно информирани за практиките на самоуправление, включително важността на правилното съхранение на Byetta, инжектиране техника, време на дозиране на Byetta, както и съпътстващи перорални лекарства, спазване на планирането на хранене, редовна физическа активност, периодично мониторинг на кръвната захар и изследване на HbA1c, разпознаване и управление на хипогликемия и хипергликемия и оценка на диабет усложнения.
Пациентите трябва да бъдат съветвани да информират лекарите си, ако са бременни или възнамеряват да забременеят.
Всяка доза Byetta трябва да се прилага като SC инжекция в бедрото, корема или горната част на ръката по всяко време в рамките на 60-минутен период преди сутрешното и вечерно хранене (или преди двете основни хранения за деня, приблизително 6 часа или повече на части). Byetta не трябва да се прилага след хранене. Ако се пропусне доза, схемата на лечение трябва да се възобнови, както е предписано със следващата планирана доза.
Рискът от хипогликемия се повишава, когато Byetta се използва в комбинация с средство, което индуцира хипогликемия, като сулфонилурея. Симптомите, лечението и състоянията, които предразполагат развитието на хипогликемия, трябва да бъдат обяснени на пациента. Въпреки че не е необходимо да се променят обичайните инструкции на пациента за лечение на хипогликемия, тези инструкции трябва да бъдат прегледани и подсилени при започване на терапия с Byetta, особено когато се прилага едновременно със сулфонилурея (виж МЕРКИ, Хипогликемия).
Пациентите трябва да бъдат информирани, че лечението с Byetta може да доведе до намаляване на апетита, храната прием и / или телесно тегло и че не е необходимо да се променя режима на дозиране поради такъв ефекти. Лечението с Byetta може също да доведе до гадене, особено при започване на терапия (вж НЕЖЕЛАНИ РЕАКЦИИ).
Пациентът трябва да прочете вложката "Информация за пациента" и ръководството за употреба на писалка, преди да започне терапия с Byetta и да ги преглежда всеки път, когато рецептата се зарежда отново. Пациентът трябва да бъде инструктиран за правилната употреба и съхранение на писалката, като подчертава как и кога да настрои нова писалка и отбелязва, че при първоначална употреба е необходима само една стъпка за настройка. Пациентът трябва да бъде посъветван да не споделя писалката и иглите.
Пациентите трябва да бъдат информирани, че иглите за писалка не са включени в писалката и трябва да бъдат закупени отделно. Пациентите трябва да бъдат информирани коя дължина и габарит на иглата трябва да се използват.
Взаимодействия с лекарства
Ефектът на Byetta върху забавянето на стомашното изпразване може да намали степента и скоростта на абсорбция на перорално приложени лекарства. Byetta трябва да се използва с повишено внимание при пациенти, приемащи перорални лекарства, които изискват бърза стомашно-чревна абсорбция. За перорални лекарства, които зависят от праговите концентрации за ефикасност, като например контрацептиви и антибиотици, пациентите трябва да бъдат съветвани да приемат тези лекарства най-малко 1 час преди това Инжектиране на Byetta. Ако такива лекарства трябва да се прилагат с храна, пациентите трябва да бъдат съветвани да ги приемат с храна или закуска, когато Byetta не се прилага. Ефектът на Byetta върху абсорбцията и ефективността на оралните контрацептиви не е характеризиран.
Варфарин
При контролирано клинично фармакологично проучване при здрави доброволци се наблюдава забавяне на варфарин Tmax от около 2 часа, когато варфарин е прилаган 30 минути след Byetta. Не са наблюдавани клинично значими ефекти върху Cmax или AUC. От въвеждането на пазара обаче има спонтанно съобщени случаи на увеличени INR (Международно нормализирано съотношение) при едновременна употреба на варфарин и Байета, понякога свързана с кървене.
Канцерогенеза, мутагенеза, увреждане на плодовитостта
Проведено е 104-седмично проучване за канцерогенност при мъжки и женски плъхове в дози 18, 70 или 250 mcg / kg / ден, прилагани чрез болус SC инжекция. Доброкачествените тиреоидни С-клетъчни аденоми са наблюдавани при женски плъхове при всички дози на екзенатид. Честотата на женските плъхове е била 8% и 5% в двете контролни групи и 14%, 11% и 23% в групите с ниска, средна и висока доза със системна експозиция от 5, 22 и 130 пъти, съответно, излагането на човека в резултат на максималната препоръчителна доза от 20 mcg / ден, на базата на плазмена площ под кривата (AUC).
При 104-седмично проучване за канцерогенност при мишки при дози 18, 70 или 250 mcg / kg / ден, прилагани чрез болус SC инжектиране, не са наблюдавани данни за тумори при дози до 250 mcg / kg / ден, системна експозиция до 95 пъти по-голяма от експозицията на човека в резултат на максималната препоръчителна доза от 20 mcg / ден, на базата на AUC.
Есенатидът не е мутагенен или кластогенен, със или без метаболитна активация в анализа на бактериалната мутагенност на Ames или хромозомната аберация в клетките на яйчниците на китайски хамстер. Екзенатидът е отрицателен при in vivo анализ на микронуклеуси при мишки.
При проучвания за плодовитост при мишки с SC дози от 6, 68 или 760 mcg / kg / ден, мъжете са били лекувани 4 седмици преди до и през чифтосването и женските са били третирани 2 седмици преди и през чифтосването до деня на бременност 7. Не се наблюдава неблагоприятен ефект върху плодовитостта при 760 mcg / kg / ден, системна експозиция 390 пъти по-голяма от експозицията на човека в резултат на максималната препоръчителна доза от 20 mcg / ден, на базата на AUC.
бременност
Бременност категория С
Доказано е, че Exenatide причинява намален растеж на плода и новороденото и скелетни ефекти при мишки при системна експозиция 3 пъти по-голяма от експозицията на човека в резултат на максималната препоръчителна доза от 20 mcg / ден, на базата на AUC. Доказано е, че Exenatide причинява скелетни ефекти при зайци при системна експозиция, 12 пъти по-голяма от експозицията на човека в резултат на максималната препоръчителна доза от 20 mcg / ден, на базата на AUC. Няма адекватни и добре контролирани проучвания при бременни жени. Byetta трябва да се използва по време на бременност, само ако потенциалната полза оправдава потенциалния риск за плода.
При женски мишки, получаващи SC дози от 6, 68 или 760 mcg / kg / ден, започващи 2 седмици преди и по време на чифтосването до 7-ия гестационен ден, не е имало неблагоприятни фетални ефекти при дози до 760 mcg / kg / ден, системни експозиции до 390 пъти по-високи от експозицията при хора в резултат на максималната препоръчителна доза от 20 mcg / ден, въз основа на AUC.
При бременни мишки, получаващи дози на SC от 6, 68, 460 или 760 mcg / kg / ден от деня на гестация 6 до 15 (органогенеза), цепнато небце (някои с дупки) и неправилен скелет осификация на костите на ребрата и черепа се наблюдава при 6 mcg / kg / ден, системна експозиция 3 пъти по-голяма от експозицията на човека в резултат на максималната препоръчителна доза от 20 mcg / kg / ден, на базата на AUC.
При бременни зайци, на които са дадени SC дози от 0,2, 2, 22, 156 или 260 mcg / kg / ден от гестационния ден 6 до 18 (органогенеза), нередовни скелети осификации са наблюдавани при 2 mcg / kg / ден, системна експозиция 12 пъти по-голяма от експозицията при хора в резултат на максималната препоръчителна доза от 20 mcg / ден, на базата на AUC.
При бременни мишки, на които са дадени SC дози от 6, 68 или 760 mcg / kg / ден от деня на бременност 6 до деня на кърмене 20 (отбиване), се наблюдава увеличен брой смъртни случаи при новородени. в дни след раждането 2-4 в язовирите с 6 mcg / kg / ден, системна експозиция 3 пъти по-голяма от експозицията на човека в резултат на максималната препоръчителна доза от 20 mcg / ден, на базата на AUC.
Кърмещи майки
Не е известно дали ексенатид се екскретира в кърмата. Много лекарства се екскретират в кърмата и поради потенциала за клинично значими нежелани реакции при кърмачета от ексенатид, решение трябва да се вземе решение дали да се прекрати производството на мляко за консумация или да се прекрати употребата на лекарството, като се вземе предвид значението на лекарството за кърмещите жена. Проучвания при кърмещи мишки показват, че ексенатид присъства в ниски концентрации в мляко (по-малко или равно на 2,5% от концентрацията в майчината плазма след подкожно дозиране). Трябва да се внимава, когато Byetta се прилага на кърмачка.
Педиатрична употреба
Безопасността и ефективността на Byetta не са установени при педиатрични пациенти.
Гериатрична употреба
Byetta е проучен при 282 пациенти на възраст 65 или повече години и при 16 пациенти на възраст 75 и повече години. Не са наблюдавани разлики в безопасността или ефективността между тези пациенти и по-младите пациенти.
Горна част
Нежелани реакции
Използвайте с метформин и / или сулфонилурея
В трите контролирани 30-седмични проучвания на добавка на Byetta към метформин и / или сулфонилурея, нежелани събития с честота â ¥ 5% (без хипогликемия; виждам Таблица 3), които се срещат по-често при пациенти, лекувани с Byetta, в сравнение с пациенти, лекувани с плацебо, са обобщени в таблица 4.
Таблица 4: Чести нежелани лекарствени реакции (‰ ¥ 5% честота и по-голяма честота при лечение с Byetta), с изключение на хипогликемия *
| Плацебо BID N = 483 % |
Всички Bideta BID N = 963 % |
|
|---|---|---|
| ||
| гадене | 18 | 44 |
| повръщане | 4 | 13 |
| диария | 6 | 13 |
| Чувство на нервност | 4 | 9 |
| виене на свят | 6 | 9 |
| главоболие | 6 | 9 |
| Диспепсия | 3 | 6 |
Нежеланите събития, свързани с Byetta, обикновено са леки до умерени по интензивност. Най-често съобщаваното нежелано събитие, леко до умерено гадене, се наблюдава по начин, зависим от дозата. При продължителна терапия честотата и тежестта намаляват с времето при повечето пациенти, които първоначално са изпитвали гадене. Нежелани събития, съобщени при ¥ ¥ 1,0 до <5,0% от пациентите, получаващи Byetta и съобщавани по-често, отколкото при плацебо включва астения (предимно отчетена като слабост), намален апетит, гастроезофагеална рефлуксна болест и хиперхидроза. Пациентите в проучванията за удължаване на 52 седмици са имали подобни видове нежелани реакции, наблюдавани в 30-седмичните контролирани проучвания.
Честотата на оттегляне поради нежелани събития е 7% за пациенти, лекувани с Byetta, и 3% за пациенти, лекувани с плацебо. Най-честите нежелани събития, водещи до отнемане на пациенти, лекувани с Byetta, са гадене (3% от пациентите) и повръщане (1%). При пациенти, лекувани с плацебо, <1% се оттегли поради гадене и 0% поради повръщане.
Използвайте с тиазолидиндион
В 16-седмичното плацебо-контролирано проучване на добавката на Byetta към тиазолидиндион, със или без метформин, честотата и вида на други наблюдавани нежелани събития са подобни на наблюдаваните в 30-седмичните контролирани клинични изпитвания с метформин и / или а сулфонилурея. Не са съобщени сериозни нежелани реакции в рамото на плацебо. Две сериозни нежелани събития, а именно болка в гърдите (водеща до отнемане) и хроничен свръхчувствителен пневмонит, са били докладвани в рамото на Баета.
Честотата на оттегляне поради нежелани събития е 16% (19/121) при пациенти, лекувани с Byetta, и 2% (2/112) при пациенти, лекувани с плацебо. Най-честите нежелани реакции, водещи до отнемане на пациенти, лекувани с Byetta, са гадене (9%) и повръщане (5%). При пациенти, лекувани с плацебо, <1% се оттегли поради гадене. Втрисане (n = 4) и реакции на мястото на инжектиране (n = 2) се наблюдават само при пациенти, лекувани с Byetta. Двамата пациенти, които съобщават за реакция на мястото на инжектиране, имат високи титри на антиексенатидно антитяло.
Спонтанни данни
След въвеждането на пазара на Byetta са докладвани следните допълнителни нежелани реакции. Тъй като тези събития се отчитат доброволно от популация с несигурен размер, не винаги е възможно надеждно да се прецени тяхната честота или да се установи причинно-следствена връзка с експозицията на наркотици.
Общи: реакции на мястото на инжектиране; промяна на вкуса; сънливост, INR се увеличава при едновременна употреба на варфарин (някои съобщения, свързани с кървене).
Алергия / свръхчувствителност: генерализиран сърбеж и / или уртикария, макулен или папуларен обрив, ангиоедем; редки съобщения за анафилактична реакция.
Стомашно-чревни: гадене, повръщане и / или диария, което води до дехидратация; коремна дистензия, коремна болка, еруктация, запек, метеоризъм, остър панкреатит.
Бъбречни и пикочни нарушения: променена бъбречна функция, включително остра бъбречна недостатъчност, влошена хронична бъбречна недостатъчност, бъбречно увреждане, повишен серумен креатинин (вж. МЕРКИ).
Имуногенност
В съответствие с потенциално имуногенните свойства на протеинови и пептидни фармацевтични продукти, пациентите могат да развият антиексенатидни антитела след лечение с Byetta. При повечето пациенти, които развиват антитела, титрите на антителата намаляват с времето.
В 30-седмичните контролирани изпитвания на добавка на Byetta към метформин и / или сулфонилурея, 38% от пациентите са имали антиексенатидни антитела с нисък титър на 30 седмици. За тази група нивото на гликемичен контрол (HbA1c) като цяло е сравнимо с това, наблюдавано при тези без титри на антитела. Допълнителни 6% от пациентите са имали антитела с по-висок титър на 30 седмици. При около половината от тези 6% (3% от общия брой пациенти, дадени на Byetta в 30-седмичните контролирани проучвания), гликемичният отговор на Byetta е отслабен; останалата част има гликемичен отговор, съпоставим с този на пациенти без антитела.
В 16-седмичното проучване на добавката на Byetta към тиазолидиндиони, със или без метформин, 9% от пациентите са имали антитела с по-висок титър на 16 седмици. В сравнение с пациенти, които не са разработили антитела срещу Byetta, средно гликемичният отговор при пациенти с антитела с по-висок титър е бил атенюиран.
Трябва да се следи гликемичният отговор на пациента към Byetta. Ако има влошаващ се гликемичен контрол или не е постигнат целенасочен гликемичен контрол, трябва да се обмисли алтернативна антидиабетна терапия.
Горна част
Предозирането
В клинично проучване на Byetta, трима пациенти с диабет тип 2 преживяват еднократно предозиране от 100 mcg SC (10 пъти максималната препоръчителна доза). Ефектите от предозирането включват силно гадене, силно повръщане и бързо намаляващи концентрации на глюкоза в кръвта. Един от тримата пациенти изпита тежка хипогликемия, изискваща парентерално приложение на глюкоза. Тримата пациенти се възстановиха без усложнения. В случай на предозиране трябва да се започне подходящо поддържащо лечение според клиничните признаци и симптоми на пациента.
Горна част
Дозировка и приложение
Лечението с Byetta трябва да се започне с 5 mcg на доза, прилагана два пъти дневно по всяко време в рамките на 60 минути период преди сутрешното и вечерното хранене (или преди двете основни хранения за деня, приблизително 6 часа или повече на части). Byetta не трябва да се прилага след хранене. Въз основа на клиничния отговор дозата на Byetta може да бъде увеличена до 10 mcg два пъти дневно след 1 месец терапия. Всяка доза трябва да се прилага като SC инжекция в бедрото, корема или горната част на ръката.
Byetta се препоръчва за употреба при пациенти със захарен диабет тип 2, които вече получават метформин, сулфонилурея, тиазолидиндион, комбинация от метформин и сулфонилурея или комбинация от метформин и тиазолидиндион и имат неоптимални стойности гликемичен контрол. Когато Byetta се добави към терапията с метформин или тиазолидиндион, настоящата доза метформин или тиазолидиндион може да бъде продължена тъй като е малко вероятно дозата на метформин или тиазолидиндион да изисква коригиране поради хипогликемия, когато се използва с Byetta. Когато Byetta се добави към терапията със сулфонилурея, може да се обмисли намаляване на дозата на сулфонилурея с цел намаляване на риска от хипогликемия (вж. МЕРКИ, Хипогликемия).
Byetta е бистра и безцветна течност и не трябва да се използва, ако се появят частици или ако разтворът е мътен или оцветен. Byetta не трябва да се използва след датата на изтичане. Няма данни за безопасността или ефикасността на интравенозно или интрамускулно инжектиране на Byetta.
Горна част
съхранение
Преди първата употреба, Byetta трябва да се съхранява в хладилник при температура от 2 ° C до 8 ° C от 36 ° F до 46 ° F. След първата употреба Byetta може да се поддържа при температура, която не надвишава (25 ° C) 77 ° F. Не замръзвайте. Не използвайте Byetta, ако е замразена. Byetta трябва да бъде защитен от светлина. Писалката трябва да се изхвърли 30 дни след първата употреба, дори ако някои лекарства остават в писалката.
Горна част
Как се доставя
Byetta се доставя като стерилен разтвор за подкожна инжекция, съдържащ 250 mcg / ml ексенатид. Предлагат се следните пакети:
5 mcg на доза, 60 дози, 1,2 ml предварително напълнена писалка NDC 66780-210-07
10 mcg на доза, 60 дози, 2,4 ml предварително напълнена писалка NDC 66780-210-08
Rx САМО
Произведено за Amylin Pharmaceuticals, Inc., Сан Диего, CA 92121
Пазарувана от Amylin Pharmaceuticals, Inc. и Ели Лили и компания
1-800-868-1190
http://www.Byetta.com
Byetta е регистрирана търговска марка на Amylin Pharmaceuticals, Inc.
© 2007 Amylin Pharmaceuticals, Inc. Всички права запазени.
последна актуализация на 09/2007
Информация за пациента на Byetta (Exenatide) (на обикновен английски)
Подробна информация за признаците, симптомите, причините, лечението на диабета
Информацията в тази монография не е предназначена да обхване всички възможни употреби, указания, предпазни мерки, лекарствени взаимодействия или нежелани ефекти. Тази информация е обобщена и не е предназначена за конкретни медицински съвети. Ако имате въпроси относно лекарствата, които приемате или искате повече информация, консултирайте се с Вашия лекар, фармацевт или медицинска сестра.
обратно към: Прегледайте всички лекарства за диабет



