Starlix за лечение на диабет
Име на марката: Starlix
Родово име: таблетки натеглинид
Съдържание:
описание
Клинична фармакология
Клинични изследвания
Показания и употреба
Противопоказания
предпазни мерки
Нежелани реакции
Предозирането
Дозировка и приложение
Как се доставя
Starlix, натеглинид, пълна информация за пациента (на обикновен английски)
описание
Starlix® (натеглинид) е перорален антидиабетичен агент, използван при лечението на захарен диабет тип 2 [известен също като неинсулинозависим захарен диабет (NIDDM) или диабет при възрастни]. Starlix, (-) - N - [(транс-4-изопропилциклохексан) карбонил] -D-фенилаланин, структурно не е свързан с пероралните секретагози на сулфонилурея.
Структурната формула е както е показано
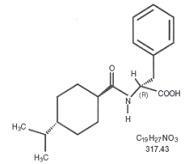
Nateglinide е бял прах с молекулно тегло 317,43. Той е свободно разтворим в метанол, етанол и хлороформ, разтворим в етер, слабо разтворим в ацетонитрил и октанол и практически неразтворим във вода. Starlix двойно изпъкнали таблетки съдържат 60 mg или 120 mg натеглинид за орално приложение.
Неактивни съставки: колоиден силициев диоксид, кроскармелоза натрий, хидроксипропил метилцелулоза, железни оксиди (червени или жълт), лактоза монохидрат, магнезиев стеарат, микрокристална целулоза, полиетилен гликол, повидон, талк и титан диоксид.
Горна част
Клинична фармакология
Механизъм на действие
Натеглинид е аминокиселинно производно, което понижава нивата на кръвната захар, като стимулира секрецията на инсулин от панкреаса. Това действие зависи от функционирането на бета-клетки на островите на панкреаса. Натеглинид взаимодейства с АТФ-чувствителния калиев (К + АТФ) канал на панкреатичните бета-клетки. Последващата деполяризация на бета-клетката отваря калциевия канал, произвеждайки калциев приток и секреция на инсулин. Степента на отделяне на инсулин зависи от глюкозата и намалява при ниски нива на глюкоза. Nateglinide е силно селективен за тъканите с нисък афинитет към сърдечния и скелетния мускул.
Фармакокинетика
абсорбция
След перорално приложение непосредствено преди хранене, натеглинид бързо се абсорбира със средни пикови плазмени концентрации на лекарството (Cmax), които обикновено се проявяват в рамките на 1 час (Tmax) след дозиране. Когато се прилага на пациенти с диабет тип 2 в диапазон от дози 60 mg до 240 mg три пъти дневно за един седмица, натеглинид демонстрира линейна фармакокинетика както за AUC (площ под кривата на концентрация време / плазма), така и за Стах. Установено е също, че Tmax е независим от дозата при тази група пациенти. Абсолютната бионаличност е оценена на приблизително 73%. Когато се прилага с или след хранене, степента на абсорбция на натеглинид (AUC) остава незасегната. Въпреки това, има забавяне на скоростта на абсорбция, характеризиращо се с намаляване на Cmax и забавяне във времето до пикова плазмена концентрация (Tmax). Плазмените профили се характеризират с множество пикови плазмени концентрации, когато натеглинид се прилага при гладуване. Този ефект се намалява, когато натеглинид се приема преди хранене.
разпределение
Въз основа на данни след венозно (IV) приложение на натеглинид, стабилният обем на разпределение на натеглинид се оценява приблизително на 10 литра при здрави индивиди. Натеглинид е силно свързан (98%) със серумните протеини, предимно серумен албумин, и в по-малка степен Î ± 1 киселинен гликопротеин. Степента на свързване на серумния протеин не зависи от концентрацията на лекарството в тестовия диапазон от 0,1-10 µg / mL.
метаболизъм
Натеглинид се метаболизира от оксидазната система със смесена функция преди елиминирането. Основните пътища на метаболизма са хидроксилирането, последвано от глюкоронидна конюгация. Основните метаболити са по-малко мощни антидиабетни средства, отколкото натеглинид. Изопреновият минорен метаболит притежава сила подобна на тази на основното съединение натеглинид.
Данните in vitro показват, че натеглинидът се метаболизира предимно от цитохром Р450 изоензими CYP2C9 (70%) и CYP3A4 (30%).
отделяне
Натеглинид и неговите метаболити бързо и напълно се елиминират след перорално приложение. В рамките на 6 часа след дозиране приблизително 75% от прилагания 14С-натеглинид се възстановява в урината. Осемдесет и три процента от 14С-натеглинид се екскретира с урината с допълнителни 10% елиминиран в изпражненията. Приблизително 16% от 14С-натеглинид се екскретира с урината като основно съединение. Във всички проучвания на здрави доброволци и пациенти с диабет тип 2 плазмените концентрации на натеглинид бързо намаляват със среден елиминационен полуживот от около 1,5 часа. В съответствие с този кратък елиминационен полуживот, няма очевидно натрупване на натеглинид при многократно дозиране до 240 mg три пъти дневно в продължение на 7 дни.
Взаимодействия с лекарства
Изследванията за метаболизъм на лекарства in vitro показват, че Starlix се метаболизира предимно от цитохром Р450 изоцим CYP2C9 (70%) и в по-малка степен CYP3A4 (30%). Starlix е потенциален инхибитор на изоензима CYP2C9 in vivo, както е показано от способността му да инхибира in vitro метаболизма на толбутамид. Инхибирането на метаболитни реакции на CYP3A4 не е открито при in vitro експерименти.
Глибурид: В рандомизирано кръстосано проучване с множество дози са пациенти с диабет тип 2 прилага 120 mg Starlix три пъти дневно преди хранене в продължение на 1 ден в комбинация с глибурид 10 mg дневно. Няма клинично значими промени във фармакокинетиката на нито едно от лекарствата.
Метформин: Когато Starlix 120 mg три пъти дневно преди хранене се прилага в комбинация с метформин 500 mg три пъти дневно при пациенти с диабет тип 2, няма клинично значими промени във фармакокинетиката на нито една от двете агент.
Дигоксин: Когато Starlix 120 mg преди хранене се прилага в комбинация с единична доза от 1 mg дигоксин при здрави доброволци, няма клинично значими промени във фармакокинетиката на нито една от двете агент.
Варфарин: Когато на здрави индивиди са прилагани Starlix 120 mg три пъти дневно преди хранене в продължение на четири дни комбинация с еднократна доза варфарин 30 mg на 2-ри ден, няма промяна във фармакокинетиката на нито една от двете агент. Протромбиновото време не се повлиява.
Диклофенак: Прилагане на сутрешни и обедни дози на Starlix 120 mg в комбинация с единични 75 mg дозата на диклофенак при здрави доброволци не доведе до значителни промени във фармакокинетиката на нито една от двете агент.
Специални популации
Гериатрична: Възрастта не повлиява фармакокинетичните свойства на натеглинид. Следователно не са необходими корекции на дозата при пациенти в напреднала възраст.
Пол: Не са наблюдавани клинично значими разлики във фармакокинетиката на натеглинид между мъже и жени. Следователно не е необходимо коригиране на дозата въз основа на пола.
Раса: Резултатите от популационния фармакокинетичен анализ, включващ лица от кавказки, черен и друг етнически произход, предполагат, че расата има малко влияние върху фармакокинетиката на натеглинид.
Бъбречно увреждане: в сравнение със здрави съвпадащи пациенти, пациенти с диабет тип 2 и умерена до тежка бъбречна недостатъчност (CrCl 15-50 ml / min), която не е на диализа, е показана подобно очевидно клирънс, AUC и Cmax. Пациентите с диабет тип 2 и бъбречна недостатъчност при диализа показват намалена обща експозиция на лекарства. Въпреки това, пациентите на хемодиализа също са намалили свързването на плазмените протеини в сравнение с съвпадащите здрави доброволци.
Чернодробно увреждане: Пиковата и общата експозиция на натеглинид при пациенти, които не са диабетици с лека чернодробна недостатъчност, са увеличени с 30% в сравнение със съвпадащи здрави индивиди. Starlix® (натеглинид) трябва да се използва с повишено внимание при пациенти с хронично чернодробно заболяване. (Вижте Мерки за безопасност, Чернодробно увреждане.)
Фармакодинамика
Starlix се абсорбира бързо и стимулира секрецията на панкреатичен инсулин в рамките на 20 минути след перорално приложение. Когато Starlix се дозира три пъти дневно преди хранене, има бързо повишаване на плазмения инсулин, като пиковите нива са приблизително 1 час след дозирането и спад до изходното ниво до 4 часа след приема.
В двойно сляпо, контролирано клинично изпитване, в което Starlix е прилаган преди всяко от трите хранене, плазмените нива на глюкоза се определят за 12-часов, дневен период след 7 седмици от лечение. Starlix се прилага 10 минути преди хранене. Храненията се основаваха на стандартни менюта за поддържане на диабетно тегло с общото калорично съдържание въз основа на височината на всеки пациент. Starlix произвежда статистически значимо намаление на глицемията на гладно и постпрандиал в сравнение с плацебо.
Горна част
Клинични изследвания
Общо 3566 пациенти бяха рандомизирани в девет двойно слепи, плацебо- или активно контролирани проучвания с продължителност 8 до 24 седмици, за да се оцени безопасността и ефикасността на Starlix® (натеглинид). 3513 пациенти имат стойности на ефикасност извън изходните стойности. В тези проучвания Starlix се прилага до 30 минути преди всяко от три основни хранения дневно.
Starlix® монотерапия в сравнение с плацебо
В рандомизирано, двойно сляпо, плацебо-контролирано 24-седмично проучване, пациенти с диабет тип 2 с HbA1C ‰ 8 6,8% само при диета са рандомизирани да получават или Starlix (60 mg или 120 mg три пъти дневно преди хранене), или плацебо. Основната стойност на HbA1C варира от 7,9% до 8,1%, а 77,8% от пациентите преди това не са лекувани с перорална антидиабетна терапия. Пациентите, лекувани преди това с антидиабетни лекарства, трябваше да прекратят това лечение за най-малко 2 месеца преди рандомизацията. Добавянето на Starlix преди хранене доведе до статистически значимо намаление на средния HbA1C и средната плазмена глюкоза на гладно (FPG) в сравнение с плацебо (вж. Таблица 1). Намаленията на HbA1C и FPG са сходни за пациентите, които не са били подложени на, и тези, изложени преди това на антидиабетни лекарства.
В това проучване се съобщава за един епизод на тежка хипогликемия (плазмена глюкоза <36 mg / dL) при пациент, лекуван със 120 mg Starlix три пъти дневно преди хранене. Нито един пациент не е имал хипогликемия, която изисква помощ от трети страни. Пациентите, лекувани със Starlix, имат статистически значимо средно увеличение на теглото в сравнение с плацебо (вж. Таблица 1).
В друго рандомизирано, двойно-сляпо, 24-седмично, активно и плацебо-контролирано проучване, пациенти с диабет тип 2 бяха рандомизирани да получават Starlix (120 mg три пъти дневно преди хранене), метформин 500 mg (три пъти дневно), комбинация от Starlix 120 mg (три пъти дневно преди хранене) и метформин 500 mg (три пъти дневно), или плацебо. Базовата стойност на HbA1C варира от 8,3% до 8,4%. Петдесет и седем процента от пациентите преди това не са лекувани с перорална антидиабетна терапия. Монотерапията със Starlix доведе до значително намаляване на средния HbA1C и средния FPG в сравнение с плацебо, които бяха подобни на резултатите от проучването, докладвано по-горе (вж. Таблица 2).
Таблица 1: Резултати от крайната точка за 24-седмично проучване с фиксирана доза на монотерапия Starlix®
|
Плацебо |
Starlix® 60 mg три пъти ежедневно преди ядене |
Starlix® 120 mg три пъти ежедневно преди ядене |
|
| HbA1С (%) | N = 168 | N = 167 | N = 168 |
| Базова линия (средно) | 8.0 | 7.9 | 8.1 |
| Промяна от началната линия (средно) | +0.2 | -0.3 | -0.5 |
| Разлика от плацебо (средно) | -0.5 а | -0.7 а | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Базова линия (средно) | 167.9 | 161.0 | 166.5 |
| Промяна от началната линия (средно) | +9.1 | +0.4 | -4.5 |
| Разлика от плацебо (средно) | -8.7 а | -13.6 а | |
| Тегло (кг) | N = 170 | N = 169 | N = 166 |
| Базова линия (средно) | 85.8 | 83.7 | 86.3 |
| Промяна от началната линия (средно) | -0.7 | +0.3 | +0.9 |
| Разлика от плацебо (средно) | +1.0 а | +1.6 а |
p-стойност ‰ ¤ 0,004
Starlix® монотерапия в сравнение с други перорални антидиабетни средства
глибурид
В 24-седмично, двойно сляпо, активно контролирано проучване, пациенти с диабет тип 2, които са били на сулфонилурея за â months 3 месеца и които имаха изходна стойност HbA1C - ¥ ‰ 6.5% бяха рандомизирани да получават Starlix (60 mg или 120 mg три пъти дневно преди хранене) или глибурид 10 mg веднъж дневно. Пациентите, рандомизирани на Starlix, имат значително повишаване на средната стойност на HbA1C и средната FPG в крайна точка в сравнение с пациенти, рандомизирани на глибурид.
Метформин
В друго рандомизирано, двойно-сляпо, 24-седмично, активно и плацебо-контролирано проучване, пациенти с диабет тип 2 бяха рандомизирани да получават Starlix (120 mg три пъти дневно преди хранене), метформин 500 mg (три пъти дневно), комбинация от Starlix 120 mg (три пъти дневно преди хранене) и метформин 500 mg (три пъти дневно), или плацебо. Базовата стойност на HbA1C варира от 8,3% до 8,4%. Петдесет и седем процента от пациентите преди това не са лекувани с перорална антидиабетна терапия. Намаляването на средната HbA1C и средната FPG в крайна точка с моноформин с метформин е значително по-голямо от намалението на тези променливи при монотерапия със Starlix (виж таблица 2). В сравнение с плацебо монотерапията със Starlix се свързва със значително увеличение на средното тегло, докато монотерапията с метформин е свързана със значително намаляване на средното тегло. Сред подгрупата пациенти, които преминават към антидиабетна терапия, намалението на средната стойност на HbA1C и средната FPG за монотерапия със Starlix са подобни на тези за монотерапия с метформин (вж. Таблица 2). Сред подгрупата пациенти, лекувани преди това с други антидиабетни средства, предимно глибурид, HbA1C в Starlix групата с монотерапия се увеличава леко от изходната стойност, докато HbA1C е намален в групата за монотерапия с метформин (виж таблицата 2).
Starlix® комбинирана терапия
Метформин
В друго рандомизирано, двойно-сляпо, 24-седмично, активно и плацебо-контролирано проучване, пациенти с диабет тип 2 бяха рандомизирани да получават Starlix (120 mg три пъти дневно преди хранене), метформин 500 mg (три пъти дневно), комбинация от Starlix 120 mg (три пъти дневно преди хранене) и метформин 500 mg (три пъти дневно), или плацебо. Базовата стойност на HbA1C варира от 8,3% до 8,4%. Петдесет и седем процента от пациентите преди това не са лекувани с перорална антидиабетна терапия. Пациентите, лекувани преди това с антидиабетни медикаменти, трябваше да преустановят приема на лекарства поне 2 месеца преди рандомизация. Комбинацията от Starlix и метформин доведе до статистически значително по-големи намаления на HbA1C и FPG в сравнение с монотерапията Starlix или метформин (вж. Таблица 2). Starlix, самостоятелно или в комбинация с метформин, значително намали повишаването на прандиалната глюкоза от преди хранене до 2 часа след хранене в сравнение с плацебо и метформин самостоятелно.
В това проучване се съобщава за един епизод на тежка хипогликемия (плазмена глюкоза ‰ ¤ 36 mg / dL) при пациент, получаващ комбинация от Starlix и метформин и четири епизода на тежка хипогликемия са съобщени при един пациент в метформин рамо за лечение. Нито един пациент не е имал епизод на хипогликемия, която изисква помощ от трети страни. В сравнение с плацебо монотерапията със Starlix се свързва със статистически значимо увеличение на теглото, т.е. докато съществена промяна в теглото не е наблюдавана при комбинирана терапия със Starlix и метформин (вж. таблица 2).
В друго 24-седмично, двойно сляпо, плацебо-контролирано проучване, за първи път са въведени пациенти с диабет тип 2 с HbA1C ¥ ¥ 6,8% след лечение с метформин (‰ ¥ 1500 mg дневно за ‰ ¥ 1 месец). в период на изтичане на четири седмици монотерапия с метформин (2000 mg дневно) и след това се рандомизира за получаване на Starlix (60 mg или 120 mg три пъти дневно преди хранене) или плацебо в допълнение към метформин. Комбинираната терапия със Starlix и метформин се свързва със статистически значително по-големи намаления на HbA1C в сравнение с монотерапията с метформин (-0,4% и -0,6% за Starlix 60 mg и Starlix 120 mg плюс метформин, съответно).
Таблица 2: Резултати от крайната точка за 24-седмично проучване на Starlix®монотерапия и комбинация с метформин
|
Плацебо |
Starlix® 120 mg три пъти всеки ден преди ястия |
Метформин 500 mg три пъти ежедневно |
Starlix® 120 mg преди хранене плюс Метформин * |
|
| HbA1С (%) | ||||
| всичко | N = 160 | N = 171 | N = 172 | N = 162 |
| Базова линия (средно) | 8.3 | 8.3 | 8.4 | 8.4 |
| Промяна от началната линия (средно) | +0.4 | -0.4 ж.к. | -0.8 ° С | -1.5 |
| Разлика от плацебо | -0.8 а | -1.2 а | -1.9 а | |
| Nan-положителни | N = 98 | N = 99 | N = 98 | N = 81 |
| Базова линия (средно) | 8.2 | 8.1 | 8.3 | 8.2 |
| Промяна от началната линия (средно) | +0.3 | -0.7 ° С | -0.8 ° С | -1.6 |
| Разлика от плацебо | -1.0 а | -1.1 а | -1.9 а | |
| Не-нан-положителни | N = 62 | N = 72 | N = 74 | N = 81 |
| Базова линия (средно) | 8.3 | 8.5 | 8.7 | 8.7 |
| Промяна от началната линия (средно) | +0.6 | +0.004 ж.к. | -0.8 ° С | -1.4 |
| Разлика от плацебо | -0.6 а | -1.4 а | -2.0 а | |
| FPG (mg / dL) | ||||
| всичко | N = 166 | N = 173 | N = 174 | N = 167 |
| Базова линия (средно) | 194.0 | 196.5 | 196.0 | 197.7 |
| Промяна от началната линия (средно) | +8.0 | -13.1 ж.к. | -30.0 ° С | -44.9 |
| Разлика от плацебо | -21.1 а | -38.0 а | -52.9 а | |
| Тегло (кг) | ||||
| всичко | N = 160 | N = 169 | N = 169 | N = 160 |
| Базова линия (средно) | 85.0 | 85.0 | 86.0 | 87.4 |
| Промяна от началната линия (средно) | -0.4 | +0.9 ж.к. | -0.1 | +0.2 |
| Разлика от плацебо | +1.3 а | +0.3 | +0.6 |
p-стойност â ‰ ¤ 0,05 vs. плацебо
b p-стойност â ‰ ¤ 0,03 vs. метформин
c p-стойност â ‰ ¤ 0,05 vs. съчетание
* Метформин се прилага три пъти дневно
розиглитазон
Проведено е 24-седмично двойно сляпо многоцентрово плацебо-контролирано проучване при пациенти с тип 2 диабет не е адекватно контролиран след терапевтичен отговор на монотерапия с розиглитазон 8 mg дневно. Добавянето на Starlix (120 mg три пъти на ден с хранене) се свързва със статистически значително по-големи намаления на HbA1C в сравнение с монотерапията с розиглитазон. Разликата беше -0,77% на 24 седмици. Средната промяна в теглото спрямо изходната стойност е около +3 kg за пациенти, лекувани със Starlix плюс розиглитазон спрямо около +1 kg за пациенти, лекувани с плацебо плюс розиглитазон.
глибурид
В 12-седмично проучване на пациенти с диабет тип 2, недостатъчно контролиран на глибурид 10 mg веднъж дневно, добавянето на Starlix (60 mg или 120 mg три пъти дневно преди хранене) не доведе до допълнителни изгода.
Горна част
Показания и употреба
Starlix® (натеглинид) е показан като допълнение към диетата и упражненията за подобряване на гликемичния контрол при възрастни със захарен диабет тип 2.
Горна част
Противопоказания
Starlix® (натеглинид) е противопоказан при пациенти с:
1. Известна свръхчувствителност към лекарството или неговите неактивни съставки.
2. Диабет тип 1.
3. Диабетна кетоацидоза. Това състояние трябва да се лекува с инсулин.
Горна част
предпазни мерки
Макроваскуларни резултати: Няма клинични проучвания, установяващи категорични доказателства за намаляване на макроваскуларния риск със Starlix или друго антидиабетно лекарство.
Хипогликемия: Всички перорални лекарства за понижаване на глюкозата в кръвта, които се абсорбират системно, са способни да предизвикат хипогликемия. Честотата на хипогликемията е свързана с тежестта на диабета, нивото на гликемичния контрол и други характеристики на пациента. Гериатричните пациенти, недохранените пациенти и тези с надбъбречна или хипофизна недостатъчност или тежко бъбречно увреждане са по-податливи на ефекта на понижаване на глюкозата при тези лечения. Рискът от хипогликемия може да бъде увеличен при усилено физическо натоварване, прием на алкохол, недостатъчен прием на калории на остра или хронична основа или комбинации с други перорални антидиабетици агенти. Хипогликемията може да бъде трудно разпознаваема при пациенти с автономна невропатия и / или тези, които използват бета-блокери. Starlix® (натеглинид) трябва да се прилага преди хранене, за да се намали рискът от хипогликемия. Пациентите, които прескачат храненето, трябва също да прескачат планираната доза Starlix, за да намалят риска от хипогликемия.
Чернодробно увреждане: Starlix трябва да се използва с повишено внимание при пациенти с умерено до тежко чернодробно заболяване, тъй като такива пациенти не са проучвани.
Загуба на гликемичен контрол
Преходна загуба на гликемичен контрол може да настъпи с температура, инфекция, травма или операция. Инсулиновата терапия може да е необходима вместо Starlix терапия в такива моменти. Възможно е да възникне вторична недостатъчност или намалена ефективност на Starlix за определен период от време.
Информация за пациенти
Пациентите трябва да бъдат информирани за потенциалните рискове и ползи от Starlix и за алтернативните методи на терапия. Трябва да се обяснят рисковете и управлението на хипогликемията. Пациентите трябва да бъдат инструктирани да приемат Starlix 1 до 30 минути преди да приемат храна, но да прескачат планираната доза, ако прескочат храненето, така че рискът от хипогликемия ще бъде намален. Лекарствените взаимодействия трябва да се обсъждат с пациентите. Пациентите трябва да бъдат информирани за потенциални лекарствени взаимодействия със Starlix.
Лабораторни тестове
Реакцията на терапиите трябва периодично да се оценява с стойности на глюкоза и нива на HbA1C.
Взаимодействия с лекарства
Nateglinide е силно свързан с плазмените протеини (98%), главно с албумина. Изследвания за изместване на ин витро със силно свързани с протеин лекарства като фуроземид, пропранолол, каптоприл, никардипин, правастатин, глибурид, варфарин, фенитоин, ацетилсалицилова киселина, толбутамид и метформин не показват влияние върху степента на натеглинид протеин задължителен. По същия начин, натеглинид не оказва влияние върху свързването на серумния протеин на пропранолол, глибурид, никардипин, варфарин, фенитоин, ацетилсалицилова киселина и толбутамид in vitro. Въпреки това, разумната оценка на отделните случаи е оправдана в клиничните условия.
Някои лекарства, включително нестероидни противовъзпалителни средства (НСПВС), салицилати, инхибитори на моноаминооксидазата и неселективни бета-адренергични блокиращи средства могат да засилят хипогликемичното действие на Starlix и други перорални антидиабетици наркотици.
Някои лекарства, включително тиазиди, кортикостероиди, продукти на щитовидната жлеза и симпатомиметици, могат да намалят хипогликемичното действие на Starlix и други перорални антидиабетни лекарства.
Когато тези лекарства се прилагат или се изтеглят от пациенти, получаващи Starlix, пациентът трябва да се наблюдава отблизо за промени в гликемичния контрол.
Лекарствени / хранителни взаимодействия
Фармакокинетиката на натеглинид не се повлиява от състава на хранене (високо съдържание на протеини, мазнини или въглехидрати). Въпреки това, пиковите плазмени нива са значително намалени, когато Starlix се прилага 10 минути преди течна храна. Starlix не е оказал никакъв ефект върху стомашното изпразване при здрави индивиди, както е оценено чрез тестване на ацетаминофен.
Канцерогенеза / мутагенеза / увреждане на плодовитостта
Канцерогенност: Проведено е двегодишно проучване за канцерогенност при плъхове Sprague-Dawley с перорални дози натеглинид до 900 mg / kg / ден, което води до експозиция на AUC при мъжки и женски плъхове приблизително 30 и 40 пъти терапевтична експозиция при човека съответно с препоръчителна доза Starlix от 120 mg, три пъти дневно преди ястия. Проведено е двугодишно проучване за канцерогенност при мишки B6C3F1 с перорални дози натеглинид до 400 mg / kg / ден, което води до експозиция на AUC при мъже и женски мишки, приблизително 10 и 30 пъти терапевтична експозиция при хора с препоръчителна доза Starlix от 120 mg, три пъти дневно преди хранене. Не са открити доказателства за туморогенен отговор нито при плъхове, нито при мишки.
Мутагенеза: Натеглинидът не е генотоксичен при in vitro теста на Еймс, анализ на миши лимфом, анализ на хромозомни аберации в белодробни клетки на китайски хамстер или в in vivo тест за микронуклеус на мишка.
Нарушаване на фертилитета: Плодовитостта не се повлиява от прилагането на натеглинид на плъхове в дози до 600 mg / kg (приблизително 16 пъти повече от терапевтичната експозиция при хора с препоръчителна доза Starlix от 120 mg три пъти дневно преди това ястия).
бременност
Бременност Категория С
Натеглинид не е бил тератогенен при плъхове в дози до 1000 mg / kg (приблизително 60 пъти терапевтична експозиция при хора с препоръчителна доза Starlix от 120 mg, три пъти дневно преди хранене). При заека ембрионалното развитие е повлияно неблагоприятно и честотата на агенезата на жлъчния мехур или малкия жлъчен мехур е увеличена при доза от 500 mg / kg (приблизително 40 пъти терапевтична експозиция при хора с препоръчителна доза Starlix от 120 mg, три пъти дневно преди това ястия). Няма адекватни и добре контролирани проучвания при бременни жени. Starlix не трябва да се използва по време на бременност.
Труд и доставка
Ефектът на Starlix върху раждането и раждането при хората не е известен.
Кърмещи майки
Проучвания при кърмещи плъхове показват, че натеглинид се екскретира в млякото; съотношението AUC0-48h в мляко и плазма е приблизително 1: 4. По време на пери- и постнаталния период теглото на тялото е по-ниско при потомство на плъхове, прилагани натеглинид, при 1000 mg / kg (приблизително 60 пъти повече от терапевтичната експозиция при хора с препоръчителна доза Starlix от 120 mg, три пъти дневно преди това ястия). Не е известно дали Starlix се екскретира в кърмата. Тъй като много лекарства се екскретират в кърмата, Starlix не трябва да се прилага на кърмачка.
Педиатрична употреба
Безопасността и ефективността на Starlix при педиатрични пациенти не са установени.
Гериатрична употреба
Не са наблюдавани разлики в безопасността или ефикасността на Starlix между пациенти на възраст 65 и повече години и тези под 65 години. Въпреки това, по-голяма чувствителност на някои по-възрастни индивиди към Starlix терапия не може да бъде изключена.
Горна част
Нежелани реакции
В клинични проучвания приблизително 2600 пациенти с диабет тип 2 са били лекувани със Starlix® (натеглинид). От тях приблизително 1335 пациенти са били лекувани 6 месеца или повече и приблизително 190 пациенти за една година или повече.
Хипогликемията е сравнително рядка при всички терапевтични групи от клиничните проучвания. Само 0,3% от пациентите на Starlix са прекратени поради хипогликемия. Стомашно-чревни симптоми, особено диария и гадене, не са по-чести при пациенти, използващи комбинацията от Starlix и метформин, отколкото при пациенти, получаващи само метформин. По същия начин периферният оток не се среща по-често при пациенти, използващи комбинацията от Starlix и розиглитазон, отколкото при пациенти, получаващи самостоятелно розиглитазон. Следващата таблица изброява събития, появяващи се по-често при пациенти със Starlix, отколкото пациенти с плацебо в контролирани клинични изпитвания.
Чести нежелани събития (‰ ¥ 2% при пациенти на Starlix®) в проучвания за монотерапия на Starlix® (% от пациентите)
| Плацебо | Starlix® | |
| N = 458 | N = 1441 | |
| Предпочитан срок | ||
| Горна респираторна инфекция | 8.1 | 10.5 |
| Болка в гърба | 3.7 | 4.0 |
| Симптоми на грип | 2.6 | 3.6 |
| виене на свят | 2.2 | 3.6 |
| артропатия | 2.2 | 3.3 |
| диария | 3.1 | 3.2 |
| Случайна травма | 1.7 | 2.9 |
| бронхит | 2.6 | 2.7 |
| Кашлицата | 2.2 | 2.4 |
| Хипогликемията | 0.4 | 2.4 |
По време на постмаркетинговия опит са съобщени редки случаи на реакции на свръхчувствителност като обрив, сърбеж и уртикария. По подобен начин са съобщени случаи на жълтеница, холестатичен хепатит и повишени чернодробни ензими.
Лабораторни отклонения
Пикочна киселина: Има увеличение на средните нива на пикочна киселина при пациенти, лекувани само със Starlix, Starlix в комбинация с метформин, метформин самостоятелно и само глибурид. Съответните разлики от плацебо са били 0,29 mg / dL, 0,45 mg / dL, 0,28 mg / dL и 0,19 mg / dL. Клиничното значение на тези открития не е известно.
Горна част
Предозирането
В клинично проучване при пациенти с диабет тип 2 се прилага Starlix® (натеглинид) увеличаване на дозите до 720 mg дневно в продължение на 7 дни и няма клинично значими нежелани събития Отчетените. Не са наблюдавани случаи на предозиране със Starlix в клинични изпитвания. Предозирането обаче може да доведе до преувеличен ефект на понижаване на глюкозата с развитието на хипогликемични симптоми. Хипогликемичните симптоми без загуба на съзнание или неврологични находки трябва да се лекуват с перорална глюкоза и корекции в дозировката и / или модела на хранене. Тежките хипогликемични реакции с кома, гърч или други неврологични симптоми трябва да се лекуват с интравенозна глюкоза. Тъй като натеглинидът е силно свързан с протеини, диализата не е ефективно средство за отстраняването му от кръвта.
Горна част
Дозировка и приложение
Starlix® (натеглинид) трябва да се приема 1 до 30 минути преди хранене.
Монотерапия и комбинация с метформин или тиазолидиндион
Препоръчителната начална и поддържаща доза на Starlix, самостоятелно или в комбинация с метформин или тиазолидиндион, е 120 mg три пъти дневно преди хранене.
Дозата от 60 mg Starlix, самостоятелно или в комбинация с метформин или тиазолидиндион, може да се използва при пациенти, които са близо до цел HbA1C при започване на лечение.
Дозировка при гериатрични пациенти
Обикновено не са необходими специални корекции на дозата. Въпреки това, по-голяма чувствителност на някои хора към Starlix терапия не може да бъде изключена.
Дозировка при бъбречно и чернодробно увреждане
Не е необходимо коригиране на дозата при пациенти с лека до тежка бъбречна недостатъчност или при пациенти с лека чернодробна недостатъчност. Не е проучвано дозиране на пациенти с умерена до тежка чернодробна дисфункция. Следователно, Starlix трябва да се използва с повишено внимание при пациенти с умерено до тежко чернодробно заболяване (вж. ПРЕДПАЗНИ МЕРКИ, Чернодробно увреждане).
Горна част
Как се доставя
Starlix® (натеглинид) таблетки
60 mg
Розов, кръгъл, скосен ръб таблетка с надпис "Starlix" от едната страна и "60" от другата.
Бутилки от 100... NDC 0078-0351-05
120 mg
Жълта, овалоидна таблетка с надпис "Starlix" от едната страна и "120" от другата.
Бутилки от 100... NDC 0078-0352-05
съхранение
Да се съхранява при 25 ° C (77 ° F); разрешени екскурзии до 15 ºC-30 ºC (59 ºF-86 ºF).
Разпределете в тесен контейнер, USP.
T2008-01
REV: ЮЛИ 2008 г.
Произведен от:
Novartis Pharma Stein AG
Щайн, Швейцария
Разпространено от:
Novartis Pharmaceuticals Corporation
Източен Хановер, Ню Джърси 07936
© Novartis
Последна актуализация 07/2008
Starlix, натеглинид, пълна информация за пациента (на обикновен английски)
Подробна информация за признаците, симптомите, причините, лечението на диабета
Информацията в тази монография не е предназначена да обхване всички възможни употреби, указания, предпазни мерки, лекарствени взаимодействия или нежелани ефекти. Тази информация е обобщена и не е предназначена като специфичен медицински съвет. Ако имате въпроси относно лекарствата, които приемате или искате повече информация, консултирайте се с Вашия лекар, фармацевт или медицинска сестра.
обратно към: Прегледайте всички лекарства за диабет



