Именда: Лечение на Алцхаймер
Namenda е медикамент, използван при лечението на болестта на Алцхаймер. Подробна информация за употребата, дозировката, страничните ефекти на Namenda.
Марка: Namenda
Родово име: Мемантин хидрохлорид
Namenda (мемантин хидрохлорид) е лекарство, използвано за лечение на болестта на Алцхаймер. По-долу подробна информация за употребата, дозировката и страничните ефекти на Namenda.
Съдържание:
описание
фармакология
Показания и употреба
Противопоказания
предпазни мерки
Взаимодействия с лекарства
Нежелани реакции
свръх доза
дозиране
Доставя
Инструкции за пациента
Информация за пациента на Namenda (на обикновен английски)
описание
Namenda® (мемантин хидрохлорид) е орално активен антагонист на NMDA рецептора. Химичното наименование на мемантин хидрохлорид е 1-амино-3,5-диметиладамантан хидрохлорид със следната структурна формула:
Източник: Forest Laboratories, американски дистрибутор или Namenda.
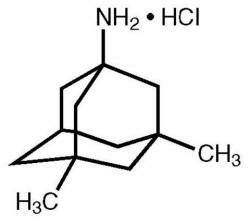
Молекулната формула е C 12 H 21 N · HCl, а молекулното тегло е 215.76.
Мемантин HCl се среща като фин бял до почти бял прах и е разтворим във вода. Namenda се предлага под формата на таблетки или като перорален разтвор. Namenda се предлага за перорално приложение като капсула, филмирани таблетки, съдържащи 5 mg и 10 mg мемантин хидрохлорид. Таблетките съдържат и следните неактивни съставки: микрокристална целулоза, лактоза монохидрат, колоиден силициев диоксид, талк и магнезиев стеарат. В допълнение, следните неактивни съставки също присъстват като компоненти на филмовото покритие: хипромелоза, триацетин, титанов диоксид, FD&C жълто # 6 и FD&C синьо # 2 (5 mg таблетки), железен оксид черен (10 mg таблетки). Пероралният разтвор на Namenda съдържа мемантин хидрохлорид със сила, еквивалентна на 2 mg мемантин хидрохлорид във всеки мл. Пероралният разтвор също съдържа следните неактивни съставки: сорбитолов разтвор (70%), метил парабен, пропилпарабен, пропилен гликол, глицерин, натурален аромат на мента # 104, лимонена киселина, натриев цитрат и пречистен вода.
Клинична фармакология
Механизъм на действие и фармакодинамика
Устойчиво активиране на N-метил-D-аспартат (NMDA) рецептори на централната нервна система от хипотезата на възбудимата аминокиселина глутамат допринася за симптоматиката на Болест на Алцхаймер. Мемантинът е постулиран да упражнява терапевтичния си ефект чрез своето действие като нисък до умерен афинитет неконкурентен (отворен канал) антагонист на NMDA рецептор, който се свързва за предпочитане с NMDA рецептор, управляван катионни канали. Няма доказателства, че мемантинът предотвратява или забавя невродегенерацията при пациенти с болестта на Алцхаймер.
Мемантинът показва нисък до незначителен афинитет към GABA, бензодиазепин, допамин, адренергични, хистаминови и глицинови рецептори и за зависими от напрежението Са2+, Na + или К + канали. Мемантинът също показва антагонистични ефекти на 5HT3 рецептора с потентност, подобна на тази за NMDA рецептора и блокира никотиновите ацетилхолинови рецептори с една шеста до една десета от потентността.
Проучванията in vitro показват, че мемантинът не влияе на обратимото инхибиране на ацетилхолинестераза от донепезил, галантамин или такрин.
Фармакокинетика
Мемантин се абсорбира добре след перорално приложение и има линейна фармакокинетика в терапевтичния диапазон на дозите. Той се екскретира предимно с урината, непроменен и има терминален полуживот около 60-80 часа.
Поглъщане и разпределение
След перорално приложение мемантин се абсорбира силно с максимални концентрации, достигнати за около 3-7 часа. Храната няма ефект върху абсорбцията на мемантин. Средният обем на разпределение на мемантин е 9-11 L / kg, а свързването с плазмените протеини е ниско (45%).
Метаболизъм и елиминиране
Мемантинът претърпява частичен чернодробен метаболизъм. Около 48% от прилаганото лекарство се екскретира непроменено с урината; останалата част се превръща главно в три полярни метаболити, които притежават минимален NMDA рецептор антагонистична активност: N-глюкуронид конюгат, 6-хидрокси мемантин и 1-нитрозо дезаминиран мемантин. Общо 74% от приложената доза се отделя като сума от основното лекарство и N-глюкуронид конюгат. Чернодробната микрозомна ензимна система CYP450 не играе значителна роля в метаболизма на мемантина. Мемантинът има терминален полуживот на около 60-80 часа. Бъбречният клирънс включва активна тубулна секреция, модерирана от рН-зависима тубулна реабсорбция.
Специални популации
Бъбречна недостатъчност: Фармакокинетиката на мемантина се оценява след еднократно перорално приложение на 20 mg мемантин НС1 при 8 пациенти с леко бъбречно увреждане. (креатининов клирънс, CLcr,> 50 - 80 ml / min), 8 пациенти с умерено бъбречно увреждане (CLcr 30 - 49 ml / min), 7 пациенти с тежко бъбречно увреждане (CLcr 5 - 29 ml / min) и 8 здрави индивида (CLcr> 80 ml / min) съвпадат възможно най-близо по възраст, тегло и пол към субектите с бъбречна функция увреждане. Средната AUC 0- (безкрайност) се увеличава съответно с 4%, 60% и 115% при лица с леко, умерено и тежко бъбречно увреждане в сравнение със здрави индивиди. Терминалният полуживот на елиминиране се увеличава съответно с 18%, 41% и 95% при лица с леко, умерено и тежко бъбречно увреждане в сравнение със здрави индивиди.
Не се препоръчва коригиране на дозата при пациенти с леко и умерено бъбречно увреждане. Дозировката трябва да бъде намалена при пациенти с тежко бъбречно увреждане (вж. ДОЗИРОВКА И ПРИЛОЖЕНИЕ).
Възрастен: Фармакокинетиката на Namenda при млади и възрастни пациенти е сходна.
пол: След многократно приложение на Namenda 20 mg b.i.d., жените имат около 45% по-висока експозиция от мъжете, но няма разлика в експозицията, когато телесното тегло е взето предвид.
Лекарствени и лекарствени взаимодействия
Субстрати на микрозомални ензими: Изследвания in vitro показват, че при концентрации, превишаващи тези, свързани с ефикасността, мемантинът не индуцира цитохром Р450 изозимите CYP1A2, CYP2C9, CYP2E1 и CYP3A4 / 5. В допълнение, in vitro проучванията показват, че мемантинът произвежда минимално инхибиране на CYP450 ензимите CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 и CYP3A4. Тези данни показват, че не се очакват фармакокинетични взаимодействия с лекарства, метаболизирани от тези ензими.
Инхибитори на микрозомални ензими: Тъй като мемантинът преминава в минимален метаболизъм, като по-голямата част от дозата се екскретира непроменена с урината, взаимодействие между мемантин и лекарства, които са инхибитори на ензимите CYP450, е малко вероятно. Едновременното приложение на Namenda с AChE инхибитор донепезил HCl не влияе върху фармакокинетиката на нито едно от съединенията.
Лекарства, елиминирани чрез бъбречни механизми: Мемантин се елиминира отчасти чрез тръбна секреция. In vivo проучвания показват, че многократните дози диуретик хидрохлоротиазид / триамтерен (HCTZ / ТА) не влияят на AUC на мемантин в стационарно състояние. Мемантинът не повлиява бионаличността на ТА и намалява AUC и C max на HCTZ с около 20%. Едновременното приложение на мемантин с антихипергликемичното лекарство Glucovance® (глибурид и метформин НС1) не повлиява фармакокинетиката на мемантин, метформин и глибурид. Мемантин не променя ефектите на Glucovance® за понижаване на серумната глюкоза, което показва липсата на фармакодинамично взаимодействие.
Лекарства, които правят урината алкална: Клирънсът на мемантин беше намален с около 80% при алкални условия на урина при pH 8. Следователно, промяната на рН на урината към алкалното състояние може да доведе до натрупване на лекарството с възможно увеличаване на неблагоприятните ефекти. Лекарствата, които алкализират урината (напр. Инхибитори на карбоанхидразата, натриев бикарбонат), се очаква да намалят бъбречното елиминиране на мемантина.
Лекарства, силно свързани с плазмените протеини: Тъй като свързването на мемантин с плазмените протеини е ниско (45%), взаимодействие с лекарства, които са силно свързани с плазмените протеини, като варфарин и дигоксин, е малко вероятно.
КЛИНИЧНИ ИЗПИТВАНИЯ
Ефективността на Namenda (мемантин хидрохлорид) като лечение за пациенти с умерена до тежка болест на Алцхаймер е доказана в 2 рандомизирани, двойно слепи, плацебо-контролирани клинични проучвания (проучвания 1 и 2), проведени в Съединените щати, които оценяват както когнитивната функция, така и ежедневната функция. Средната възраст на пациентите, участващи в тези две изпитвания, е била 76 с диапазон от 50-93 години. Приблизително 66% от пациентите са жени, а 91% от пациентите са кавказки.
Трето проучване (проучване 3), проведено в Латвия, включва пациенти с тежка деменция, но не оценява когнитивната функция като планирана крайна точка.
Мерки за резултатите от проучването: Във всяко американско проучване ефективността на Namenda се определя с помощта на двата инструмента създаден за оценка на цялостната функция чрез оценка, свързана с полагащите грижи, и инструмент, който измерва познанието. И двете проучвания показват, че пациентите на Namenda изпитват значително подобрение и при двете мерки в сравнение с плацебо.
Дневната функция се оценява и в двете проучвания, използвайки модифицираното съвместно проучване на болестта на Алцхаймер - Дейности на ежедневния опис (ADCS-ADL). ADCS-ADL се състои от изчерпателна батерия от въпроси за ADL, използвани за измерване на функционалните възможности на пациентите. Всеки артикул ADL е оценен от най-високото ниво на независимо изпълнение до пълна загуба. Изследователят извършва инвентаризацията, като интервюира болногледач, запознат с поведението на пациента. Подгрупа от 19 артикула, включително оценки на способността на пациента да яде, да се облича, да се къпе, телефон, пътуване, магазин, и извършване на други домакински задължения е валидирано за оценка на пациенти с умерена до тежка деменция. Това е модифицираният ADCS-ADL, който има обхват от 0 до 54, като по-ниските резултати показват по-голямо функционално увреждане.
Способността на Namenda да подобрява когнитивните показатели беше оценена и в двете проучвания с батерията за тежко обезценяване (SIB), многопозиционен инструмент, който е валидиран за оценка на когнитивната функция при пациенти с умерена до тежка форма деменция. SIB изследва избрани аспекти на когнитивното представяне, включително елементи на внимание, ориентация, език, памет, визуопространствена способност, конструкция, праксис и социално взаимодействие. Диапазонът за оценяване на SIB е от 0 до 100, като по-ниските резултати показват по-голямо когнитивно увреждане.
Проучване 1 (двадесет и осем седмично проучване)
В проучване с продължителност от 28 седмици, 252 пациенти с умерена до тежка вероятна болест на Алцхаймер (диагностицирана с DSM-IV и NINCDS-ADRDA критерии, с оценки за мини-психично състояние> / = 3 и! - = 14 и степен на глобална степен на влошаване 5-6) бяха рандомизирани на Namenda или плацебо. За пациенти, рандомизирани на Namenda, лечението е започнато с 5 mg веднъж дневно и се увеличава седмично с 5 mg / dayin разделени дози до доза 20 mg / ден (10 mg два пъти на ден).
Ефекти върху ADCS-ADL:
Фигура 1 показва времевия курс за промяната от изходната стойност в ADCS-ADL резултата за пациенти от двете терапевтични групи, завършващи 28 седмици от проучването. При 28 седмици лечение средната разлика в оценките за промяна на ADCS-ADL при лекуваните с Namenda пациенти в сравнение с пациентите на плацебо е била 3,4 единици. Използвайки анализ, основан на всички пациенти и провеждащ последното наблюдение на проучването напред (LOCF анализ), лечението с Namenda е статистически значително по-добро от плацебо.
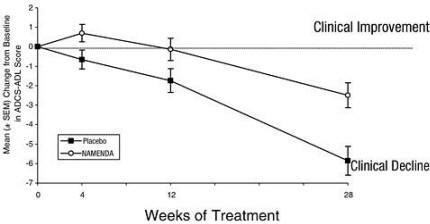
Фигура 1: Времеви ход на промяната от базовата стойност в ADCS-ADL резултата за пациенти, завършили 28 седмици лечение.
Фигура 2 показва кумулативните проценти пациенти от всяка от лекуваните групи, които са постигнали поне промяната в ADCS-ADL, показана на оста X.
Кривите показват, че както пациентите, назначени на Namenda, така и плацебо имат широк спектър от реакции и като цяло показват влошаване (a отрицателна промяна в ADCS-ADL в сравнение с базовата), но по-вероятно е групата на Namenda да покаже по-малък спад или подобрение. (В дисплей с натрупване на разпределение кривата за ефективно лечение ще бъде изместена вляво от кривата за плацебо, докато неефективното или вредно лечение ще бъде наслагвано или изместено вдясно от кривата за плацебо.)
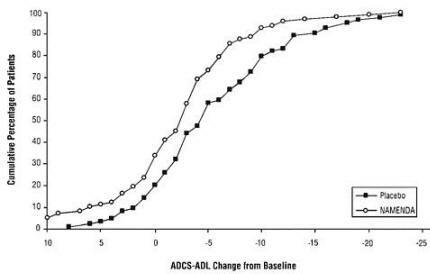
Фигура 2: Кумулативен процент от пациентите, завършили 28 седмици на двойно-сляпо лечение с конкретни промени от изходните стойности в ADCS-ADL резултатите.
Ефекти върху SIB: Фигура 3 показва времето за промяна на базовата стойност в SIB резултата за двете терапевтични групи през 28-те седмици на проучването. При 28 седмици лечение средната разлика в оценките за промяна на SIB при пациентите, лекувани с Namenda, в сравнение с пациентите на плацебо е 5,7 единици. Използвайки LOCF анализ, лечението с Namenda е статистически значително по-високо от плацебо.
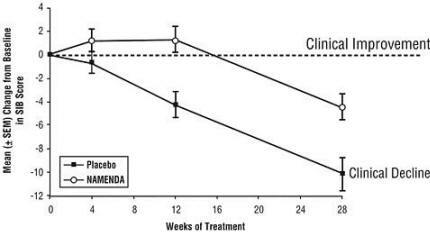
Фигура 3: Времеви ход на промяната от базовата стойност в SIB резултата за пациенти, завършили 28 седмици лечение.
Фигура 4 показва кумулативните проценти пациенти от всяка терапевтична група, които са постигнали поне мярката на промяна в SIB резултата, показана на оста X.
Кривите показват, че както пациентите, назначени на Namenda, така и плацебо имат широк спектър от отговори и като цяло показват влошаване, но по-вероятно е групата Namenda да покаже по-малък спад или а подобрение.
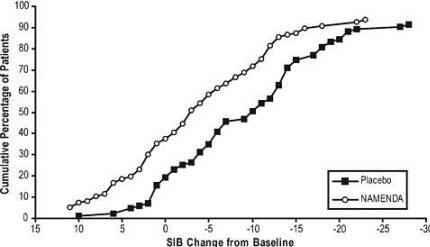
Фигура 4: Кумулативен процент от пациентите, завършили 28 седмици двойно-сляпо лечение с уточнени промени от изходните стойности в SIB.
Проучване 2 (24-седмично проучване) В проучване с продължителност 24 седмици, 404 пациенти с умерена до тежка вероятна болест на Алцхаймер (диагностицирана по критерии NINCDS-ADRDA, с Mini-Mental State Examination множество ≥ 5 и ≤ 14) които са били лекувани с донепезил в продължение на най-малко 6 месеца и които са били на стабилна доза от донепезил за последните 3 месеца бяха рандомизирани на Namenda или плацебо, докато все още получават донепезил. За пациенти, рандомизирани на Namenda, лечението е започнато с 5 mg веднъж дневно и се увеличава седмично с 5 mg / ден в разделени дози до доза 20 mg / ден (10 mg два пъти на ден).
Ефекти върху ADCS-ADL: Фигура 5 показва времевия ход за промяната от изходната стойност в резултата ADCS-ADL за двете терапевтични групи през 24-те седмици на изследването. На 24-седмично лечение, средната разлика в стойностите на ADCS-ADL за промяна на Namenda / donepezil лекувани пациенти (комбинирана терапия) в сравнение с пациентите на плацебо / донепезил (монотерапия) е 1,6 единици. Използвайки LOCF анализ, лечението с Namenda / донепезил е статистически значително по-високо от плацебо / донепезил.
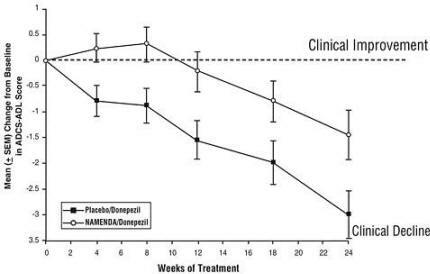
Фигура 5: Времеви ход на промяната от изходната стойност в ADCS-ADL резултата за пациенти, завършили 24 седмици лечение.
Фигура 6 показва кумулативните проценти пациенти от всяка от лекуваните групи, които са постигнали поне мярката на подобрение на ADCS-ADL, показана на оста X.
Кривите показват, че и двамата пациенти, назначени на Namenda / донепезил и плацебо / донепезил, имат широк спектър от отговори и обикновено показват влошаване, но по-вероятно е, че групата Namenda / donepezil показва по-малък спад или an подобрение.
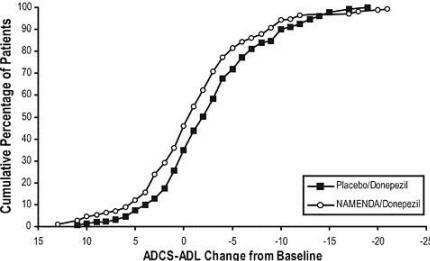
Фигура 6: Кумулативен процент на пациентите, завършили 24 седмици на двойно-сляпо лечение с конкретни промени от изходната стойност в ADCS-ADL резултатите.
Ефекти върху SIB: Фигура 7 показва хода на промяната от базовата стойност в SIB резултата за двете терапевтични групи през 24-те седмици на изследването. На 24-седмично лечение средната разлика в резултатите за промяна на SIB при пациенти, лекувани с Namenda / донепезил, в сравнение с пациентите на плацебо / донепезил е била 3,3 единици. Използвайки LOCF анализ, лечението с Namenda / донепезил е статистически значително по-високо от плацебо / донепезил.
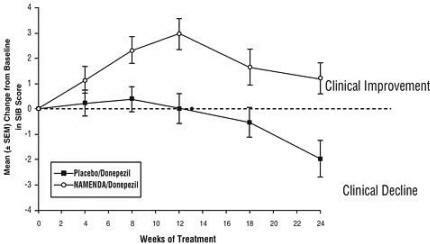
Фигура 7: Времеви ход на промяната от базовата стойност в SIB резултата за пациенти, завършили 24 седмици лечение.
Фигура 8 показва кумулативните проценти пациенти от всяка терапевтична група, които са постигнали най-малко мярката за подобрение в резултата на SIB, показана на оста X.
Кривите показват, че и двамата пациенти, назначени на Namenda / донепезил и плацебо / донепезил, имат широк диапазон от отговорите, но че е по-вероятно групата на Namenda / donepezil да покаже подобрение или по-малко намалява.
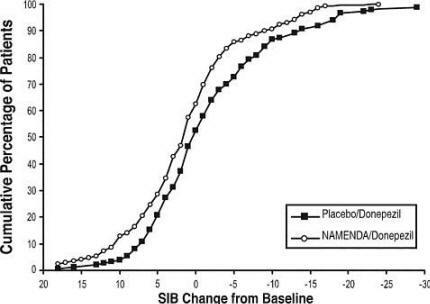
Фигура 8: Кумулативен процент от пациентите, завършили 24 седмици на двойно-сляпо лечение с конкретни промени от изходната стойност в SIB резултатите.
Проучване 3 (дванадесетседмично проучване) В двойно сляпо проучване с продължителност 12 седмици, проведено в старчески домове в Латвия, 166 пациенти с деменция според до DSM-III-R, оценка за изследване на мини-психичното състояние от <10, и глобална скала за влошаване от 5 до 7 бяха рандомизирани на Namenda или плацебо. За пациенти, рандомизирани на Namenda, лечението е започнато с 5 mg веднъж дневно и се увеличава до 10 mg веднъж дневно след 1 седмица. Основните мерки за ефикасност са подскалата на зависимостта от грижа на скалата за оценка на поведение при гериатрични пациенти (BGP), мярка за ежедневната функция и клинично глобално впечатление за промяна (CGI-C), мярка за цялостна клинична ефект. В това проучване не е използвана валидна мярка за когнитивна функция. Статистически значима разлика в лечението на 12 седмици, която предпочиташе Namenda спрямо плацебо, се наблюдава и при двете основни мерки за ефикасност. Тъй като въвежданите пациенти са смесица от болестта на Алцхаймер и съдовата деменция, беше направен опит да се разграничат двете групи и всички по-късно пациентите бяха определени като имат съдова деменция или болест на Алцхаймер, въз основа на техните резултати по исхемичната скала на Хачински при изследване влизане. Само около 50% от пациентите са имали компютърна томография на мозъка. За подмножеството, определено като болест на Алцхаймер, се наблюдава статистически значим лечебен ефект, благоприятстващ Namenda спрямо плацебо на 12 седмици както на BGP, така и на CGI-C.
Показания и употреба
Namenda (мемантин хидрохлорид) е показан за лечение на умерена до тежка деменция от типа на Алцхаймер.
Противопоказания
Namenda (мемантин хидрохлорид) е противопоказан при пациенти с известна свръхчувствителност към мемантин хидрохлорид или към всякакви помощни вещества, използвани в състава.
предпазни мерки
Информация за пациенти и болногледачи: Лекуващите трябва да бъдат инструктирани в препоръчаното приложение (два пъти на ден за дози над 5 mg) и повишаване на дозата (минимален интервал от една седмица между увеличаване на дозата).
Пристъпи на неврологични състояния:
Namenda не е систематично оценяван при пациенти с нарушение на пристъпите. В клинични изпитвания на Namenda, гърчове са възникнали при 0,2% от пациентите, лекувани с Namenda и 0,5% от пациентите, лекувани с плацебо.
Генитурологични състояния
Условия, които повишават рН на урината, могат да намалят елиминирането на мемантин в урината, което води до повишени плазмени нива на мемантин.
Специални популации
Чернодробно увреждане
Namenda претърпява частичен чернодробен метаболизъм, като около 48% от приложената доза се екскретира с урината като непроменено лекарство или като сума от основното лекарство и N-глюкуронид конюгат (74%). Фармакокинетиката на мемантин при пациенти с чернодробно увреждане не е изследвана, но се очаква да бъде повлияна само скромно.
Бъбречна недостатъчност
Не е необходимо коригиране на дозата при пациенти с леко или умерено бъбречно увреждане. Препоръчва се намаляване на дозата при пациенти с тежко бъбречно увреждане (вж КЛИНИЧНА ФАРМАКОЛОГИЯ и ДОЗИРОВКА И АДМИНИСТРАЦИЯ ).
Лекарствени и лекарствени взаимодействия
N-метил-D-аспартат (NMDA) антагонисти: Комбинираната употреба на Namenda с други NMDA антагонисти (амантадин, кетамин и декстрометорфан) не е систематично оценявана и такава употреба трябва да се подхожда с повишено внимание.
Ефекти на Namenda върху субстрати на микрозомални ензими: Проучвания in vitro, проведени с маркерни субстрати на ензими CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4), показват минимално инхибиране на тези ензими от мемантин. В допълнение, изследвания in vitro показват, че при концентрации, превишаващи тези, свързани с ефикасността, мемантинът не индуцира цитохром Р450 изозимите CYP1A2, CYP2C9, CYP2E1 и CYP3A4 / 5. Не се очакват фармакокинетични взаимодействия с лекарства, метаболизирани от тези ензими.
Ефекти на инхибитори и / или субстрати на микрозомални ензими върху Namenda: Мемантинът се елиминира предимно бъбречно и не се очаква лекарства, които са субстрати и / или инхибитори на системата CYP450, да променят метаболизма на мемантин.
Инхибитори на ацетилхолинестераза (AChE): Едновременното приложение на Namenda с AChE инхибитор донепезил HCl не повлиява фармакокинетиката на нито едно от съединенията. В 24-седмично контролирано клинично проучване при пациенти с умерена до тежка болест на Алцхаймер, вредното профилът на събитието, наблюдаван при комбинация от мемантин и донепезил, е подобен на този на донепезил сам.
Лекарства, елиминирани чрез бъбречни механизми: Тъй като мемантинът се елиминира отчасти чрез тубуларна секреция, съвместното приложение на лекарства, които използват същата бъбречна катионна система, включително хидрохлоротиазид (HCTZ), триамтерен (ТА), метформин, циметидин, ранитидин, хинидин и никотин, могат потенциално да доведат до променени плазмени нива и на двата агента. Съвместното приложение на Namenda и HCTZ / TA обаче не влияе върху бионаличността нито на мемантин, нито на TA, а бионаличността на HCTZ намалява с 20%. В допълнение, едновременното приложение на мемантин с антихипергликемичното лекарство Glucovance® (глибурид и метформин НС1) не повлиява фармакокинетиката на мемантин, метформин и глибурид. Освен това мемантинът не променя ефекта на понижаване на серумната глюкоза на Glucovance®.
Лекарства, които правят урината алкална: Клирънсът на мемантин беше намален с около 80% при алкални условия на урина при pH 8. Следователно, промяната на рН на урината към алкалното състояние може да доведе до натрупване на лекарството с възможно увеличаване на неблагоприятните ефекти. PH на урината се променя чрез диета, лекарства (напр. Инхибитори на карбоанхидразата, натриев бикарбонат) и клинично състояние на пациента (например бъбречна тубуларна ацидоза или тежки инфекции на пикочните пътища). Следователно, мемантин трябва да се използва с повишено внимание при тези условия.
Канцерогенеза, мутагенеза и увреждане на плодовитостта
Няма данни за канцерогенност при 113-седмично перорално проучване при мишки при дози до 40 mg / kg / ден (10 пъти максималната препоръчителна доза при хора [MRHD] на база mg / m 2). Няма данни за канцерогенност при плъхове, орално дозирани до 40 mg / kg / ден в продължение на 71 седмици последвано от 20 mg / kg / ден (20 и 10 пъти MRHD на база mg / m, съответно) през 128 седмици.
Мемантин не дава данни за генотоксичен потенциал, когато се оценява in vitro S. тифимуриум или Е. анализ на обратна мутация на coli, тест за in vitro хромозомна аберация в човешки лимфоцити, in vivo цитогенетичен анализ за хромозомно увреждане при плъхове и in vivo анализ на микронуклеус на мишка. Резултатите бяха категорични при in vitro тест за генна мутация с използване на клетки от китайски хамстер V79.
Не са наблюдавани нарушения на фертилността или репродуктивните показатели при плъхове, прилагани до 18 mg / kg / ден (9 пъти MRHD на mg / m 2 основа) орално от 14 дни преди чифтосване през бременност и кърмене при жени или 60 дни преди чифтосването в мъже.
бременност
Бременност Категория Б: Мемантинът, даван през устата на бременни плъхове и бременни зайци през периода на органогенезата, не е тератогенен до най-високите тествани дози (18 mg / kg / ден при плъхове и 30 mg / kg / ден при зайци, които са съответно 9 и 30 пъти максималната препоръчителна доза при хора [MRHD] на mg / m 2 база).
Лека токсичност за майката, намалено тегло на зениците и повишена честота на неокостени шийни прешлени са наблюдавани при орално приложение доза от 18 mg / kg / ден в проучване, при което плъховете получават перорален мемантин, започващ предварително чифтосване и продължаване през следродилния период месечен цикъл. Лека токсичност за майката и намалена тежест на зениците също са наблюдавани при тази доза в проучване, при което плъховете са били лекувани от 15-ия гестационен ден през периода след раждането. Дозата без ефект за тези ефекти е 6 mg / kg, което е 3 пъти повече от MRHD на mg / m 2.
Няма адекватни и добре контролирани проучвания на мемантин при бременни жени. Мемантин трябва да се използва по време на бременност, само ако потенциалната полза оправдава потенциалния риск за плода.
Кърмещи майки
Не е известно дали мемантин се екскретира в майчината кърма. Тъй като много лекарства се екскретират в кърмата, трябва да се внимава, когато мемантин се прилага на кърмачка.
Педиатрична употреба
Няма адекватни и добре контролирани изпитвания, документиращи безопасността и ефикасността на мемантин при всяко заболяване, възникващо при деца.
Нежелани реакции
Опитът, описан в този раздел, произтича от проучвания при пациенти с болестта на Алцхаймер и съдова деменция.
Нежелани събития, водещи до прекратяване: В плацебо-контролирани проучвания, при които пациентите с деменция получават дози Namenda до 20 mg / ден, вероятността от прекратяване поради нежелано събитие е била същата в групата на Namenda, както при плацебо група. Нито едно индивидуално нежелано събитие не е свързано с прекъсване на лечението при 1% или повече от пациентите, лекувани с Namenda и със скорост, по-голяма от плацебо.
Нежелани събития, докладвани в контролирани изпитвания: Съобщаваните нежелани събития в проучвания на Namenda (мемантин хидрохлорид) отразяват опит, натрупан при строго наблюдавани условия при силно подбрана популация от пациенти. В действителната практика или при други клинични изпитвания тези оценки на честотата може да не се прилагат, тъй като условията на употреба, поведението за докладване и видовете лекувани пациенти могат да се различават. В таблица 1 са изброени появяващите се от лечението признаци и симптоми, за които се съобщава при най-малко 2% от пациентите, подложени на плацебо изпитвания за деменция и при които честотата на поява е по-голяма при пациенти, лекувани с Namenda, отколкото при тези, лекувани с плацебо. Не се наблюдава нежелано събитие с честота най-малко 5% и два пъти по-голяма от скоростта на плацебо.
Система на тялото |
Плацебо (N = 922) % |
Namenda (N = 940) % |
Тяло като цяло | ||
умора |
1 | 2 |
болка |
1 | 3 |
Сърдечносъдова система | ||
Хипертония |
2 | 4 |
Централна и периферна нервна система | ||
виене на свят |
5 | 7 |
главоболие |
3 | 6 |
Стомашно-чревна система | ||
запек |
3 | 5 |
повръщане |
2 | 3 |
Мускулно-скелетна система | ||
Болка в гърба |
2 | 3 |
Психични разстройства | ||
объркване |
5 | 6 |
сънливост |
2 | 3 |
халюцинация |
2 | 3 |
Дихателната система | ||
Кашлицата |
3 | 4 |
задух |
1 | 2 |
Други нежелани събития, възникващи с честота от най-малко 2% при пациенти, лекувани с Namenda, но с по-голяма или равна честота при плацебо са били възбуда, падане, нанесени наранявания, уринарна инконтиненция, диария, бронхит, безсъние, инфекция на пикочните пътища, грипоподобни симптоми, ненормална походка, депресия, инфекция на горните дихателни пътища, тревожност, периферен оток, гадене, анорексия и артралгия.
Общият профил на нежеланите събития и степента на заболеваемост за отделни нежелани събития в субпопулацията на пациенти с умерената до тежка болест на Алцхаймер не се различава от профила и честотата на заболеваемост, описани по-горе за цялостната деменция население.
Промени в жизнения знак: Групите на Namenda и плацебо са сравнени по отношение на (1) средна промяна от изходната стойност на жизнените показатели (пулс, систолно кръвно налягане, диастолна кръв налягане и тегло) и (2) честотата на пациентите, които отговарят на критериите за потенциално клинично значими промени от изходните стойности при тях променливи. Няма клинично важни промени в жизнените показатели при пациенти, лекувани с Namenda. Сравнение на мерките за лежащи и стоящи жизнени показатели за Namenda и плацебо при възрастни нормални индивиди показва, че лечението с Namenda не е свързано с ортостатични промени.
Лабораторни промени: Наменда и плацебо групите бяха сравнени по отношение на (1) средната промяна от изходната стойност в различни серумни химии, хематология и променливи на урината и (2) честотата на пациентите, отговарящи на критериите за потенциално клинично значими промени в сравнение с изходните стойности при тези променливи. Тези анализи не показват клинично важни промени в лабораторните тестови параметри, свързани с лечението с Namenda.
Промени в ЕКГ: Групите на Namenda и плацебо са сравнени по отношение на (1) средна промяна от изходната стойност в различни параметри на ЕКГ и (2) честотата на пациентите, които отговарят на критериите за потенциално клинично значими промени в сравнение с изходните стойности променливи. Тези анализи не разкриват клинично важни промени в параметрите на ЕКГ, свързани с лечението с Namenda.
Други нежелани събития, наблюдавани по време на клинични изпитвания
Namenda е приложен на приблизително 1350 пациенти с деменция, от които повече от 1200 са получили максималната препоръчителна доза от 20 mg / ден. Пациентите са получили лечение с Namenda за периоди до 884 дни, като 862 пациенти са получавали поне 24 седмици лечение, а 387 пациенти са получавали 48 или повече седмици лечение.
Появилите се симптоми и симптоми на лечение, възникнали по време на 8 контролирани клинични изпитвания и 4 отворени етикета изпитванията са регистрирани като нежелани събития от клиничните изследователи, използвайки собствена терминология избора. За да се даде обща оценка на дела на хората, които имат подобни видове събития, събитията бяха групирани в по-малък брой стандартизирани категории, използващи терминологията на СЗО, и честотите на събитията бяха изчислени за всички проучвания.
Всички нежелани събития, възникващи при поне двама пациенти, са включени, с изключение на тези, които вече са изброени в таблица 1, и условията на СЗО обикновено да бъдат информативни, незначителни симптоми или събития, които е малко вероятно да бъдат причинени от лекарството, например, защото те са често срещани в изследването население. Събитията се класифицират по телесна система и се изброяват, като се използват следните дефиниции: чести нежелани събития - тези, които се срещат при най-малко 1/100 пациенти; редки нежелани събития - тези, които се появяват при 1/100 до 1/1000 пациенти. Тези нежелани събития не са непременно свързани с лечение с Namenda и в повечето случаи са наблюдавани с подобна честота при пациенти, лекувани с плацебо в контролираните проучвания.
Тяло като цяло: Често: синкоп. Редки: хипотермия, алергична реакция.
Сърдечносъдова система: Често: сърдечна недостатъчност. Често: ангина пекторис, брадикардия, инфаркт на миокарда, тромбофлебит, предсърдно мъждене, хипотония, спиране на сърцето, постурална хипотония, белодробна емболия, белодробен оток.
Централна и периферна нервна система: Често: преходна исхемична атака, мозъчносъдов инцидент, световъртеж, атаксия, хипокинезия. Редки: парестезия, конвулсии, екстрапирамидно разстройство, хипертония, тремор, афазия, хипостезия, анормални координация, хемиплегия, хиперкинезия, неволни мускулни контракции, ступор, мозъчен кръвоизлив, невралгия, птоза, невропатия.
Стомашно-чревна система: Често: гастроентерит, дивертикулит, стомашно-чревен кръвоизлив, мелена, язва на хранопровода.
Хемични и лимфни нарушения: Често: анемия. Често: левкопения.
Метаболитни и хранителни разстройства: Често: повишена алкална е фосфатаза, намалено тегло. Редки: дехидратация, хипонатриемия, утежнен захарен диабет.
Психични разстройства: Често: агресивна реакция. Редки: заблуда, разстройство на личността, емоционална лабилност, нервност, нарушение на съня, повишено либидо, психоза, амнезия, апатия, параноидна реакция, мислене ненормално, плач ненормално, апетит повишен, паронирия, делириум, деперсонализация, невроза, самоубийство опитвайте.
Дихателната система: Често: пневмония. Често: апнея, астма, хемоптиза.
Кожа и придатъци: Често: обрив. Редки: кожни язви, сърбеж, целулит, екзема, дерматит, еритематозен обрив, алопеция, уртикария.
Специални сетива: Често: катаракта, конюнктивит. Често: дегенерация на макула лутея, намалена зрителна острота, намален слух, шум в ушите, блефарит, замъглено зрение, непрозрачност на роговицата, глаукома, конюнктивален кръвоизлив, болка в очите, кръвоизлив в ретината, ксерофталмия, диплопия, необичайно сълзене, късогледство, отлепване на ретината.
Пикочна система: Често: често митриция. Редки: дизурия, хематурия, задържане на урина.
Събития, докладвани след маркетинга на Namenda, както САЩ, така и бивши САЩ
Въпреки че не е открита причинно-следствена връзка с лечението с мемантин, се съобщава, че следните нежелани събития са временно свързани с лечението с мемантин и не са описани на друго място в етикетирането: атриовентрикуларен блок, фрактура на костите, синдром на карпалния тунел, мозъчен инфаркт, гръдна болка, клаудикация, колит, дискинезия, дисфагия, гастрит, гастроезофагеален рефлукс, големи мал конвулсии, вътречерепно кръвоизлив, чернодробна недостатъчност, хиперлипидемия, хипогликемия, илеус, импотентност, неразположение, невролептичен злокачествен синдром, остър панкреатит, аспирационна пневмония, остра бъбречна недостатъчност, удължен QT интервал, неспокойствие, синдром на Стивънс-Джонсън, внезапна смърт, суправентрикуларна тахикардия, тахикардия, тардива дискинезия и тромбоцитопения.
ТОКСИКОЛОГИЯ НА ЖИВОТНИ
Индуцирани с мемантин невронални лезии (вакуолация и некроза) в мултиполярните и пирамидални клетки в кортикалните слоеве III и IV на задния цингулатни и ретросплениални неокортики при плъхове, подобни на тези, за които е известно, че се срещат при гризачи, прилагани други антагонисти на NMDA рецептори. Лезии се наблюдават след еднократна доза мемантин. В проучване, при което на плъхове са давани дневни перорални дози мемантин в продължение на 14 дни, дозата без ефект при невронална некроза е 6 пъти по-голяма от максималната препоръчителна доза при хора на база mg / m 2. Потенциалът за индуциране на централна невронална вакуолация и некроза от антагонисти на NMDA рецептор при хора е неизвестен.
НАРУШЕНИЕ НА ДЪРЖАВАТА И ВЗАИМОТО
Клас на контролирани вещества: Мемантин HCl не е контролирано вещество.
Физическа и психологическа зависимост: Memantine HCl е неконкурентен NMDA антагонист с нисък до умерен афинитет, който не е довел до търсене на лекарство поведение или симптоми на отнемане при прекратяване на лечение при 2,504 пациенти, участвали в клинични изпитвания в терапевтични дози. Данните за пускане на пазара извън САЩ, събрани със задна дата, не предоставят доказателства за злоупотреба с наркотици или зависимост.
свръх доза
Тъй като стратегиите за управление на предозиране непрекъснато се развиват, препоръчително е да се свържете с a център за контрол на отровата, за да определи най-новите препоръки за управление на свръхдоза лекарство.
Както във всички случаи на предозиране, трябва да се използват общи поддържащи мерки и лечението трябва да бъде симптоматично. Елиминирането на мемантин може да се засили чрез подкисляване на урината. В документиран случай на предозиране с до 400 mg мемантин, пациентът изпитва неспокойствие, психоза, зрителни халюцинации, сънливост, ступор и загуба на съзнание. Пациентът се възстановява без постоянни последствия.
Дозировка и приложение
Дозировката на Namenda (мемантин хидрохлорид), показана като ефективна при контролирани клинични изпитвания, е 20 mg / ден.
Препоръчителната начална доза на Namenda е 5 mg веднъж дневно. Препоръчителната целева доза е 20 mg / ден. Дозата трябва да се увеличава на стъпки от 5 mg до 10 mg / ден (5 mg два пъти на ден), 15 mg / ден (5 mg и 10 mg като отделни дози) и 20 mg / ден (10 mg два пъти на ден). Минималният препоръчителен интервал между увеличаването на дозата е една седмица.
Namenda може да се приема със или без храна.
Пациентите / болногледачите трябва да бъдат инструктирани как да използват дозиращото устройство Namenda Oral Solution. Те трябва да бъдат запознати с инструкцията за пациента, която е приложена към продукта. Пациентите / болногледачите трябва да бъдат инструктирани да адресират всички въпроси относно използването на разтвора до своя лекар или фармацевт.
Дози в специални популации
При пациенти с тежко бъбречно увреждане (креатининов клирънс 5 - 29 mL / min въз основа на уравнението на Cockroft-Gault) се препоръчва целева доза от 5 mg BID:
За мъже: CLcr = [140-годишна възраст (години)] · Тегло (кг) / [72 · серумен креатинин (mg / dL)]
За жени: CLcr = 0,85 · [140-годишна възраст (години)] · Тегло (кг) / [72 · серумен креатинин (mg / dL)]
Как се доставя
5 mg таблетка:
Бутилка от 60 NDC # 0456-3205-60
10 — 10 Единична доза NDC # 0456-3205-63
Филмираните таблетки във формата на капсула са с тен, като здравината (5) е вдлъбната от едната страна, а FL - от другата.
10 mg таблетка:
Бутилка от 60 NDC # 0456-3210-60
10 Ã 10 Единична доза NDC # 0456-3210-63
Филмираните таблетки във формата на капсула са сиви, като здравината (10) е релефна от едната страна, а FL - от другата.
Титриране Пак:
Пакет от PVC / алуминий, съдържащ 49 таблетки. 28 Ã 5 mg и 21 Ã 10 mg таблетки. NDC # 0456-3200-14
Филмираните таблетки с форма на капсула от 5 mg са с тен, като здравината (5) е вдлъбната от едната страна, а FL - от другата. Филмираните таблетки с форма на капсула от 10 mg са сиви, като силата (10) е релефна от едната страна, а FL - от другата.
Перорално решение:
Препоръките за дозиране за перорален разтвор са същите като тези за таблетки. Пероралният разтвор е бистър, без алкохол, без захар и мента.
2 mg / mL перорален разтвор (10 mg = 5 ml)
12 ет. унция. (360 mL) бутилка NDC # 0456-3202-12
Да се съхранява при 25 ° C (77 ° F); разрешени екскурзии до 15-30 ° C (59-86 ° F) [виж USP контролирана температура в помещението].
Forest Pharmaceuticals, Inc.
Филиал на Forest Laboratories, Inc.
Сейнт Луис, МО 63045
Лицензиран от Merz Pharmaceuticals GmbH
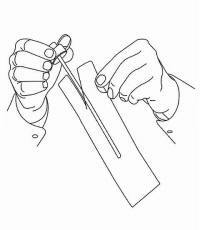
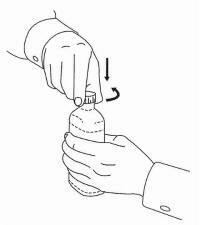
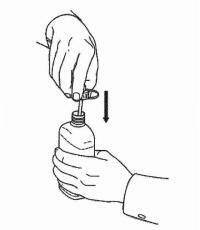
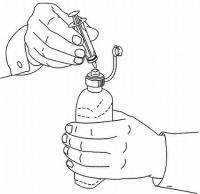
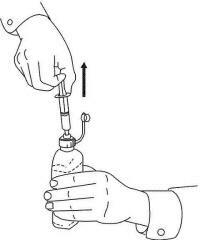
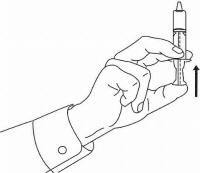
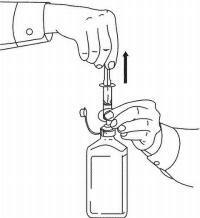
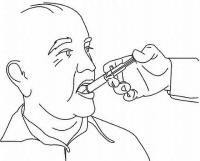
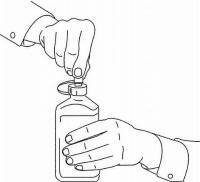
ПАЦИЕНТНИ ИНСТРУКЦИИ ЗА NAMENDA® перорален разтвор
Следвайте указанията по-долу, за да използвате устройството си за дозиране Namenda® Oral Solution.
ВАЖНО: Прочетете тези инструкции, преди да използвате Namenda® Oral Solution.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
ВАЖНО: Информацията в тази монография не е предназначена да обхване всички възможни употреби, указания, предпазни мерки, лекарствени взаимодействия или нежелани ефекти. Тази информация е обобщена и не е предназначена за конкретни медицински съвети. Ако имате въпроси относно лекарствата, които приемате или искате повече информация, консултирайте се с Вашия лекар, фармацевт или медицинска сестра. Последна актуализация 4/07
Източник: Forest Laboratories, американски дистрибутор на Namenda.
Информация за пациента на Namenda (на обикновен английски)
обратно към: Психиатрични лекарства Начална страница по фармакология



