Exubera за лечение на диабет
Марка: Exubera
Родово име: човешки инсулин
Лекарствена форма: прах за инхалация
Съдържание:
описание
Клинична фармакология
Клинични изследвания
Показания и употреба
Противопоказания
Предупреждения
предпазни мерки
Взаимодействия с лекарства
Нежелани реакции
Предозирането
Дозировка и приложение
Как се доставя
Exubera, човешки инсулин [rDNA произход] Информация за пациента (на обикновен английски)
описание
EXUBERA,® се състои от блистери, съдържащи прах за инхалация на човешки инсулин, които се прилагат с помощта на Exubera® Инхалатор. Блистери Exubera съдържат човешки инсулин, получен чрез рекомбинантна ДНК технология, използвайки непатогенен лабораторен щам на Escherichia coli (K12). Химически, човешкият инсулин има емпиричната формула С257Н383н65О77С6 и молекулно тегло 5808. Човешкият инсулин има следната първична аминокиселинна последователност:
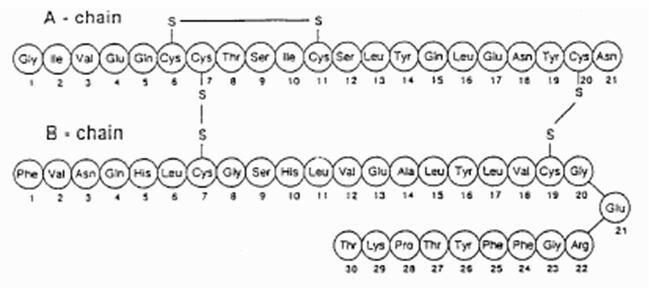
Exubera (човешки инсулин [произход на rDNA]) Прахът за инхалация е бял до почти бял прах в блистер с единична доза (пълнене на маса, виж таблица 1). Всеки блистер с единична доза на Exubera съдържа доза 1 mg или 3 mg инсулин (виж таблица 1) в a хомогенен прахообразен състав, съдържащ натриев цитрат (дихидрат), манитол, глицин и натрий хидроксид. След като блистер Exubera се постави в инхалатора, пациентът изпомпва дръжката на инхалатора и след това натиска бутон, което води до пробиване на блистера. След това инсулиновият инхалационен прах се диспергира в камерата, което позволява на пациента да вдишва аерозолизирания прах.
При стандартизирани ин витро условия за тестване Exubera доставя специфична излъчена доза инсулин от мундщука на инхалатора (виж таблица 1). Една част от общата маса на частиците се отделя като фини частици, способни да достигнат до дълбокия бял дроб. До 45% от съдържанието на блистер от 1 mg и до 25% от съдържанието на 3 mg блистер могат да бъдат задържани в блистера.
Таблица 1: Номенклатура и информация за дозата
| Попълнете маса (mg прах) |
Номинална доза (mg инсулин) |
Излъчена доза*,†(mg инсулин) |
Доза на фини частици° С,†(mg инсулин) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Реалното количество инсулин, доставен в белия дроб, ще зависи от отделните фактори на пациента, като например профила на инспираторния поток. In vitro излъчваните аерозолни показатели не се влияят при дебит над 10 L / min.
Горна част
Клинична фармакология
Механизъм на действие
Основната дейност на инсулина е регулиране на метаболизма на глюкозата. Инсулинът понижава концентрациите на глюкоза в кръвта чрез стимулиране на периферното поемане на глюкоза от скелетните мускули и мазнини и чрез инхибиране на чернодробната глюкоза. Инсулинът инхибира липолизата в адипоцита, инхибира протеолизата и засилва синтеза на протеини.
Фармакокинетика
абсорбция
Exubera доставя инсулин чрез орално вдишване. Инсулинът се абсорбира толкова бързо, колкото подкожно прилаганите бързодействащи инсулинови аналози и по-бързо от подкожно прилаган редовен човешки инсулин при здрави индивиди и при пациенти с диабет тип 1 или тип 2 (вж Фигура 1).
Фигура 1: Средни промени в серумните концентрации на свободен инсулин (µU / mL) при пациенти с диабет тип 2 следват Прилагане на единични дози инхалиран инсулин от Exubera (6 mg) и подкожен редовен човешки инсулин (18U)
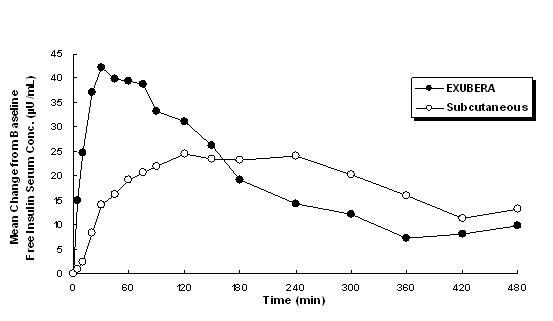
В клинични проучвания при пациенти с диабет тип 1 и тип 2, след инхалиране на Exubera, серумният инсулин достига пикова концентрация по-бързо, отколкото след подкожно инжектиране на обикновен човешки инсулин, 49 минути (в рамките на 30 до 90 минути) в сравнение с 105 минути (обхват от 60 до 240 минути), съответно.
В клинични проучвания абсорбцията на подкожен редовен човешки инсулин намалява с увеличаване на индекса на телесната маса на пациента (ИТМ). Въпреки това, абсорбцията на инсулин след вдишване на Exubera не зависи от ИТМ.
В проучване при здрави индивиди, системната експозиция на инсулин (AUC и Cmax) след прилагане на Exubera се увеличава с доза в диапазон от 1 до 6 mg, когато се прилага като комбинации от 1 и 3 mg блистери.
В проучване, при което лекарствената форма на три 1 mg блистера е сравнена с един 3 mg блистер, Cmax и AUC след прилагане на три 1 mg блистера бяха приблизително 30% и 40% по-големи от тези след прилагане на един 3 mg блистер (вж ДОЗИРОВКА И АДМИНИСТРАЦИЯ).
Разпространение и премахване
Тъй като рекомбинантният човешки инсулин е идентичен с ендогенен инсулин, се очаква системното разпределение и елиминиране да бъдат същите. Това обаче не е потвърдено за Exubera.
Фармакодинамика
Exubera, подобно на подкожно прилаганите бързодействащи инсулинови аналози, има по-бързо начало на понижаваща глюкозата активност от подкожно прилагания редовен човешки инсулин. При здрави доброволци продължителността на активността за понижаване на глюкозата за Exubera е сравнима с подкожно приложен редовен човешки инсулин и по-дълго от подкожно прилаганите бързодействащи инсулинови аналози (вж Фигура 2).
Фигура 2. Средна скорост на инфузия на глюкозата (GIR), нормализирана за GIRмакс за всеки предмет на лечение в зависимост от времето в здрави доброволци
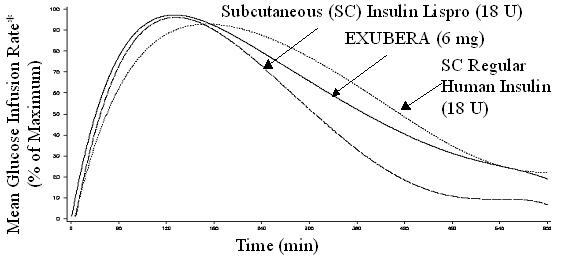
* Определя се като количество глюкоза, инфузирана за поддържане на постоянни плазмени концентрации на глюкоза, нормализирани до максимални стойности (процент от максималните стойности); показателен за инсулиновата активност.
Когато Exubera се вдишва, появата на активност за понижаване на глюкозата при здрави доброволци настъпва в рамките на 10-20 минути. Максималният ефект върху понижаването на глюкозата се упражнява приблизително 2 часа след вдишване. Продължителността на активността за понижаване на глюкозата е приблизително 6 часа.
При пациенти с диабет тип 1 или тип 2, Exubera има по-голям ефект на понижаване на глюкозата в рамките на първите два часа след приема в сравнение с подкожно прилаган редовен човешки инсулин.
Вътре-субектната променливост на понижаващата глюкозата активност на Exubera обикновено е сравнима с тази на подкожно прилагания редовен човешки инсулин при пациенти с диабет тип 1 и 2.
Специални популации
Педиатрични пациенти
При деца (6-11 години) и юноши (12-17 години) с диабет тип 1, времето за достигане на пикова концентрация на инсулин за Exubera е постигнат по-бързо, отколкото при подкожен редовен човешки инсулин, което е в съответствие с наблюденията при възрастни пациенти с тип 1 диабет.
Гериатрични пациенти
Няма видими разлики във фармакокинетичните свойства на Exubera при сравняване на пациенти на възраст над 65 години и по-млади възрастни пациенти.
пол
При лица със и без диабет не са наблюдавани видими разлики във фармакокинетичните свойства на Exubera между мъже и жени.
раса
Проведено е проучване при 25 здрави кавказки и японски лица без диабет, за да се сравни фармакокинетични и фармакодинамични свойства на Exubera срещу подкожно инжектиране на обикновени хора инсулин. Фармакокинетичните и фармакодинамичните свойства на Exubera са сравними между двете популации.
прекалена пълнота
Абсорбцията на Exubera не зависи от ИТМ на пациента.
Бъбречна недостатъчност
Ефектът на бъбречното увреждане върху фармакокинетиката на Exubera не е проучен. Може да е необходимо внимателно проследяване на глюкозата и коригиране на дозата на инсулин при пациенти с бъбречна дисфункция (вж МЕРКИ, Бъбречна недостатъчност).
Чернодробно увреждане
Ефектът на чернодробното увреждане върху фармакокинетиката на Exubera не е проучен. При пациенти с чернодробна дисфункция може да е необходимо внимателно проследяване на глюкозата и коригиране на дозата инсулин (вж МЕРКИ).
бременност
Абсорбцията на Exubera при бременни пациенти с гестационен и предгестационен диабет тип 2 е в съответствие с тази при небременни пациенти с диабет тип 2 (вж. МЕРКИ).
пушене
При пушачите се очаква системната експозиция на инсулин за Exubera да бъде 2 до 5 пъти по-висока, отколкото при непушачите. Exubera е противопоказан при пациенти, които пушат или са преустановили тютюнопушенето по-малко от 6 месеца преди започване на терапия с Exubera. Ако пациентът започне или възобнови тютюнопушенето, Exubera трябва незабавно да бъде прекратен поради повишения риск от хипогликемия и трябва да се използва алтернативно лечение (вж. ПРОТИВОПОКАЗАНИЯ).
В клиничните проучвания на Exubera при 123 пациенти (69 от които са пушачи) пушачите са имали по-бързо начало на понижаващо глюкозата действие, т.е. по-голям максимален ефект и по-голям общ ефект на понижаване на глюкозата (особено през първите 2-3 часа след дозирането) в сравнение с непушачите.
Пасивен цигарен дим
За разлика от увеличаването на експозицията на инсулин след активно тютюнопушене, когато Exubera се прилага на 30 здрави доброволци, непушачи след 2 часа експозиция на пасивен цигарен дим в контролирани експериментални условия, AUC на инсулин и Cmax бяха намалени с приблизително 20% и 30%, съответно. Фармакокинетиката на Exubera не е проучена при непушачи, които са хронично изложени на пасивен цигарен дим.
Пациенти с основни белодробни заболявания
Употребата на Exubera при пациенти с основно белодробно заболяване, като астма или ХОББ, не се препоръчва, тъй като безопасността и ефикасността на Exubera при тази популация не са установени (вж. Предупреждения). Употребата на Exubera е противопоказана при пациенти с нестабилна или лошо контролирана белодробна болест, поради широк вариации във функцията на белите дробове, които могат да повлияят на абсорбцията на Exubera и да повишат риска от хипогликемия или хипергликемия (вж ПРОТИВОПОКАЗАНИЯ).
При фармакокинетично проучване при 24 лица, които не са диабетици с лека астма, абсорбцията на инсулин след прилагане на Exubera, при липса на лечение с бронходилататор, е приблизително с 20% по-ниска от абсорбцията, наблюдавана при лица без астма. Въпреки това, в проучване при 24 лица без диабет с хронична обструктивна белодробна болест (ХОББ), системната експозицията след прилагане на Exubera е приблизително двукратно по-висока от тази при нормални лица без ХОББ (вж МЕРКИ).
Прилагане на албутерол 30 минути преди приложението на Exubera при пациенти без диабет с лека астма (n = 36) и умерена астма (n = 31) доведе до средно повишение на AUC и Cmax на инсулин между 25 и 50% в сравнение с, когато Exubera се прилага самостоятелно (вж. МЕРКИ).
Горна част
Клинични изследвания
Безопасността и ефикасността на Exubera е проучена при приблизително 2500 възрастни пациенти с диабет тип 1 и тип 2. Основният параметър за ефикасност за повечето проучвания е гликемичен контрол, измерен чрез редукцията от хемоглобин А1c (HbA1c) спрямо основната линия.
Диабет тип 1
Проведено е 24-седмично, рандомизирано, открито, активно контролно проучване (проучване A) при пациенти с диабет тип 1 за оценка на безопасността и ефикасността на Exubera, прилаган преди хранене три пъти дневно (TID) с еднократна нощна инжекция на Humulin® U Ultralente® (човешка инсулин с удължена цинкова суспензия) (n = 136). Лечението за сравняване е подкожен редовен човешки инсулин, прилаган два пъти дневно (BID) (преди закуска и преди вечеря) с BID инжекция на човешки инсулин NPH (суспензия от човешки инсулин изофан) (n = 132). В това проучване средната възраст е 38,2 години (обхват: 20-64), а 52% от субектите са мъже.
Второ 24-седмично, рандомизирано, открито, активно контролно проучване (проучване Б) е проведено при пациенти с диабет тип 1 за оценка на безопасност и ефикасност на Exubera (n = 103) в сравнение с подкожен редовен човешки инсулин (n = 103) при прилагане на TID преди ястия. И в двете ръце на лечение, NPH човешки инсулин беше приложен BID (сутрин и преди лягане) като основен инсулин. В това проучване средната възраст е 38,4 години (диапазон: 19-65) и 54% от субектите са мъже.
Във всяко проучване, намаляването на HbA1c и степента на хипогликемия са сравними за двете групи на лечение. Пациентите, лекувани с Exubera, имат по-голямо намаление на плазмената глюкоза на гладно, отколкото при пациентите от групата на сравнението. Процентът на пациентите, достигащи ниво на HbA1c <8% (за действие за лечение на Американската диабетна асоциация) Ниво към момента на провеждане на проучването) и ниво на HbA1c <7% е сравнимо между двете групи на лечение. Резултатите за проучвания А и В са показани в таблица 2.
Таблица 2: Резултати от две 24-седмични, активни контроли, отворени етикети при пациенти с диабет тип 1 (изследвания А и В)
| Проучване A | Проучване Б | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Размер на пробата | 136 | 132 | 103 | 103 |
| UL = Хумулин® U Ultralente®; SC R = подкожен редовен човешки инсулин | ||||
| ||||
| HbA1в (%) | ||||
| Базова стойност | 7.9 | 8.0 | 7.8 | 7.8 |
| Кор. средна промяна от основната линия | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera минус SC R* | 0.14 | -0.11 | ||
| 95% CI за разлика в лечението | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Плазмена глюкоза на гладно (mg / dL) | ||||
| Базова стойност | 191 | 198 | 178 | 191 |
| Кор. средна промяна от основната линия | -32 | -6 | -23 | 13 |
| Exubera минус SC R | -27 | -35 | ||
| 95% CI за разлика в лечението | (-47, -6) | (-58, -13) | ||
| 2-часова концентрация на глюкоза след прандиал (mg / dL) | ||||
| Базова стойност | 283 | 305 | 273 | 293 |
| Кор. средна промяна от основната линия | -21 | 14 | -1 | -3 |
| Exubera минус SC R | -35 | 2 | ||
| 95% CI за разлика в лечението | (-61, -8) | (-29, 32) | ||
| Пациенти с HbA в края на проучването1в < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Пациенти с HbA в края на проучването1в < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Телесно тегло | ||||
| Базова стойност средно (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Кор. средна промяна от основната линия (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera минус SC R | -0.72 | -0.24 | ||
| 95% CI за разлика в лечението | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Дневна доза инсулин в края на изследването | ||||
| Инсулин с кратко действие | 13,4 mg° С | 18.3 IU | 10,9 mg° С | 25,7 IU |
| Дългодействащ инсулин | 26.4 IU | 37.1 IU | 31.5 IU | 31,9 IU |
Диабет тип 2
Монотерапия при пациенти, които не се контролират оптимално с диета и упражнения
Проведено е 12-седмично, рандомизирано, открито, активно контролно проучване (проучване C) при пациенти с диабет тип 2, не оптимално контролирана с диета и упражнения, оценяване на безопасността и ефикасността на TID Exubera преди хранене (n = 75) в сравнение с инсулин-сенсибилизиращ агент. В това проучване средната възраст е 53,7 години (диапазон: 28-80), 55% от субектите са мъже, а средният индекс на телесната маса е 32,3 кг / м2.
На 12 седмици HbA1в нивата при пациенти лекувани с Exubera намаляват с 2,2% (SD = 1,0) от изходната стойност от 9,5% (SD = 1,1). Пропорцията на пациентите, лекувани с Exubera, достигащи HbA в края на проучването1в ниво от <8% нарасна до 82,7%. Пропорцията на пациентите, лекувани с Exubera, достигащи HbA в края на проучването1в ниво на
Монотерапия и допълнителна терапия при пациенти, лекувани преди това с орална терапия
Проведено е 12-седмично, рандомизирано, открито, активно контролно проучване (проучване D) при пациенти с тип 2 диабета, които в момента са били на лечение, но са с лош контрол, с два перорални агента (ОА). Базовите ОА включват инсулинов секретагог и метформин или тиазолидиндион. Пациентите бяха рандомизирани на една от трите групи: продължаване на OA терапията самостоятелно (n = 96), преминаване към монотерапия с TID Exubera преди хранене (n = 102) или добавяне на TID Exubera преди хранене към продължителна OA терапия (n = 100). В това проучване средната възраст е 57,4 години (диапазон: 33-80), 66% от субектите са мъже, а средният индекс на телесната маса е 30 кг / м2.
Монотерапията с Exubera и Exubera в комбинация с OA терапия бяха по-добри от терапията само с OA при намаляване на HbA1в нива от изходните стойности. Честотата на хипогликемия при двете групи на лечение с Exubera е била малко по-висока, отколкото в групата, само с OA терапия. В сравнение само с OA терапията, процентът на пациентите, достигащи до HbA1в ниво от <8% (за лечение на Американската диабетна асоциация Ниво на действие по време на провеждане на проучването) и HbA1в ниво от <7% е по-голямо при пациенти, лекувани с монотерапия с Exubera и Exubera в комбинация с OA терапия. Пациентите в двете групи на лечение с Exubera са имали по-големи намаления на плазмената глюкоза на гладно, отколкото пациентите, лекувани само с OA терапия. Резултатите за изследване D са показани в таблица 3.
Таблица 3: Резултати от 12-седмично, активно контролирано, отворено изпитване при пациенти с диабет тип 2, които не се контролират оптимално с терапия с двоен перорален агент (проучване D)
| Проучване D | Монотерапия с Exubera | ОА* | Exubera + OA |
|---|---|---|---|
| Размер на пробата | 102 | 96 | 100 |
| |||
| HbA1в (%) | |||
| Базова стойност | 9.3 | 9.3 | 9.2 |
| Кор. средна промяна от основната линия | -1.4 | -0.2 | -1.9 |
| Exubera група минус OA†| -1.18†,° С, § | -1.67†, ¶, § | |
| 95% CI за разлика в лечението | (-1.41, -0.95) | (-1.90, -1.44) | |
| Плазмена глюкоза на гладно (mg / dL) | |||
| Базова стойност | 203 | 203 | 195 |
| Кор. средна промяна от основната линия | -23 | 1 | -53 |
| Exubera група минус OA | -24° С | -53 ¶ | |
| 95% CI за разлика в лечението | (-36, -11) | (-66, -41) | |
| Пациенти с HbA в края на проучването1в < 8%# | 55.9% | 18.8% | 86.0% |
| Пациенти с HbA в края на проучването1в < 7% | 16.7% | 1.0% | 32.0% |
| Телесно тегло | |||
| Базова стойност средно (kg) | 89.5 | 88.0 | 88.6 |
| Кор. средна промяна от основната линия (kg) | 2.8 | 0.0 | 2.7 |
| Exubera група минус OA | 2.80° С | 2.75 ¶ | |
| 95% CI за разлика в лечението | (1.94, 3.65) | (1.89, 3.61) |
Проведено е 24-седмично, рандомизирано, открито, активно контролно проучване (проучване Е) при пациенти с диабет тип 2, които в момента получават терапия със сулфонилурея. Това проучване е предназначено за оценка на безопасността и ефикасността на добавянето на Exubera преди хранене терапия със сулфонилурея (n = 214) в сравнение с добавянето на метформин преди хранене към продължителната терапия със сулфонилурея (n = 196). Субектите бяха стратифицирани според техния HbA1c на седмица -1. Определени са две слоеве: нисък слой HbA1c (HbA1в ‰ ¥ 8% до ¤ .59.5%) и висок HbA1в слой (HbA)1в > 9.5 до ‰ ¤12%).
Exubera в комбинация със сулфонилурея се превъзхожда от метформин и сулфонилурея при намаляване на стойностите на HbA1c от изходните стойности в групата с висок слой. Exubera в комбинация със сулфонилурея е сравнима с метформин в комбинация със сулфонилурея при намаляване на стойностите на HbA1c от изходните стойности в групата с нисък слой. Скоростта на хипогликемия е по-висока след добавянето на Exubera към сулфонилурея, отколкото след добавянето на метформин към сулфонилурея. Процентът на пациентите, достигащи целеви стойности на HbA1c от 8% и 7%, е съпоставим между групите за лечение и в двете слоеве, както и намаляване на плазмената глюкоза на гладно (вж. Таблица 4).
Друго 24-седмично, рандомизирано, открито, активно контролно проучване (проучване F) е проведено при пациенти с диабет тип 2, които в момента получават терапия с метформин. Това проучване е предназначено за оценка на безопасността и ефикасността на добавянето на Exubera преди хранене терапия с метформин (n = 234) в сравнение с добавянето на глибенкламид преди хранене към продължителната терапия с метформин (n = 222). Субектите в това изследване също бяха стратифицирани към един от два слоя, както са дефинирани в проучване Д.
Exubera в комбинация с метформин превъзхожда глибенкламид и метформин при намаляване на HbA1в стойности от изходната стойност и постигане на целева HbA1в стойности в групата с висок слой. Exubera в комбинация с метформин е сравним с глибенкламид в комбинация с метформин за намаляване на HbA1в стойности от изходната стойност и постигане на целева HbA1в стойности в групата с нисък слой. Скоростта на хипогликемия е малко по-висока след добавянето на Exubera към метформин, отколкото след добавянето на глибенкламид към метформин. Намаляването на плазмената глюкоза на гладно е сравнимо между групите за лечение (вж Таблица 4).
Таблица 4: Резултати от две 24-седмични, активно контролирани, отворени етикети при пациенти с диабет тип 2, предишни на терапия с перорален агент (изследвания E и F)
| Проучване E | Проучване F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Met*+ СУ* | Exubera + SU* | Met*+ СУ* | Exubera + Met* | Gli* + Met* | Exubera + Met* | Gli* + Met* | |
| Висока прослойка†| Нисък слой†| Висока прослойка†| Нисък слой†| |||||
| Размер на пробата | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1в (%) | ||||||||
| Базова стойност | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Кор. средна промяна от основната линия | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera минус OA° С | -0.38° С, § | -0.07 | -0.37° С, ¶ | 0.04 | ||||
| 95% CI за разлика в лечението | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Плазмена глюкоза на гладно (mg / dL) | ||||||||
| Базова стойност | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Средна промяна от основната линия | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera минус OA | 1 | 4 | -2 | 4 | ||||
| 95% CI за разлика в лечението | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Субекти с HbA в края на изследването1в < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Субекти с HbA в края на изследването1в < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Телесно тегло | ||||||||
| Базова стойност средно (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Кор. средна промяна от основната линия (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera минус OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% CI за разлика в лечението | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Употреба при пациенти, лекувани преди това с подкожен инсулин
Проведено е 24-седмично, рандомизирано, открито, активно контролно проучване (проучване G) при пациенти, лекувани с инсулин с тип 2 диабет за оценка на безопасността и ефикасността на приема на Exubera TID преди хранене с еднократна инжекция през нощта хумулин® U Ultralente® (n = 146) в сравнение с подкожен редовен човешки инсулин, прилаган BID (преди закуска и преди вечеря) с BID инжекция на NPH човешки инсулин (n = 149). В това проучване средната възраст е 57,5 години (диапазон: 23-80), 66% от субектите са мъже, а средният индекс на телесна маса е 30,3 кг / м2.
Намаленията от изходната стойност в HbA1в, процент от пациентите, достигнали HbA1в ниво от <8% (за лечение на Американската диабетна асоциация Ниво на действие по време на провеждане на проучването) и HbA1в ниво от <7%, както и степента на хипогликемия, са сходни между групите на лечение. Пациентите, лекувани с Exubera, имат по-голямо намаление на плазмената глюкоза на гладно, отколкото при пациентите от групата на сравнението. Резултатите за изследване G са показани в таблица 5.
Таблица 5: Резултати от 24-седмично, активно контролирано отворено изпитване при пациенти с диабет тип 2, лекувани преди това с подкожен инсулин (проучване G)
| Проучване G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Размер на пробата | 146 | 149 |
| UL = Хумулин® U Ultralente®; SC R = подкожен редовен човешки инсулин | ||
| ||
| HbA1в (%) | ||
| Базова стойност | 8.1 | 8.2 |
| Кор. средна промяна от основната линия | -0.7 | -0.6 |
| Exubera минус SC R* | -0.07 | |
| 95% CI за разлика в лечението | (-0.31, 0.17) | |
| Плазмена глюкоза на гладно (mg / dL) | ||
| Базова стойност | 152 | 159 |
| Кор. средна промяна от основната линия | -22 | -6 |
| Exubera минус SC R | -16.36 | |
| 95% CI за разлика в лечението | (-27.09, -5.36) | |
| Пациенти с HbA в края на проучването1в < 8%†| 76.0% | 69.1% |
| Пациенти с HbA в края на проучването1в < 7% | 45.2% | 32.2% |
| Телесно тегло | ||
| Базова стойност средно (kg) | 90.6 | 89.0 |
| Кор. средна промяна от основната линия (kg) | 0.1 | 1.3 |
| Exubera минус SC R | -1.28 | |
| 95% CI за разлика в лечението | (-1.96, -0.60) | |
| Дневна доза инсулин в края на изследването | ||
| Инсулин с кратко действие | 16,6 mg° С | 25.5 IU |
| Дългодействащ инсулин | 37.9 IU | 52.3 IU |
Горна част
Показания и употреба
Exubera е показан за лечение на възрастни пациенти със захарен диабет за контрол на хипергликемия. Exubera има начало на действие, подобно на бързодействащи инсулинови аналози и има продължителност на понижаващата глюкозата активност, сравнима с подкожно прилагания редовен човешки инсулин. При пациенти с диабет тип 1, Exubera трябва да се използва в схеми, които включват инсулин с по-продължително действие. При пациенти с диабет тип 2, Exubera може да се използва като монотерапия или в комбинация с перорални средства или инсулини с по-продължително действие.
Горна част
Противопоказания
Exubera е противопоказан при пациенти свръхчувствителни към Exubera или към някое от помощните вещества.
Exubera е противопоказан при пациенти, които пушат или са преустановили тютюнопушенето по-малко от 6 месеца преди започване на терапия с Exubera. Ако пациентът започне или възобнови тютюнопушенето, Exubera трябва незабавно да бъде прекратен поради повишения риск от хипогликемия и трябва да се използва алтернативно лечение (вж. КЛИНИЧНА ФАРМАКОЛОГИЯ, Специални популации, Пушене). Безопасността и ефикасността на Exubera при пациенти, които пушат, не са установени.
Exubera е противопоказан при пациенти с нестабилна или лошо контролирана белодробна болест, поради големи вариации в белодробната функция, която може да повлияе на абсорбцията на Exubera и да увеличи риска от хипогликемия или хипергликемия.
Горна част
Предупреждения
Exubera се различава от обикновения човешки инсулин по бързото си начало на действие. Когато се използва като инсулин за хранене, дозата Exubera трябва да се прилага в рамките на 10 минути преди хранене.
Хипогликемията е най-често съобщаваното нежелано събитие на инсулиновата терапия, включително Exubera. Времето на хипогликемия може да се различава при различните форми на инсулин.
Пациентите с диабет тип 1 също се нуждаят от по-дългодействащ инсулин, за да поддържат адекватен контрол на глюкозата.
Всяка промяна на инсулин трябва да се извършва внимателно и само под лекарски контрол. Промените в силата на инсулина, производителя, вида (например обикновен, NPH, аналози) или видове (животни, хора) могат да доведат до необходимостта от промяна в дозата. Едновременното перорално антидиабетно лечение може да се наложи да се коригира.
Мониторингът на глюкозата се препоръчва за всички пациенти с диабет.
Поради ефекта на Exubera върху белодробната функция, всички пациенти трябва да имат оценка на белодробната функция преди започване на терапия с Exubera (вж. МЕРКИ: Белодробна функция).
Употребата на Exubera при пациенти с основно белодробно заболяване, като астма или ХОББ, не се препоръчва, тъй като безопасността и ефикасността на Exubera при тази популация не са установени (вж. МЕРКИ: Основна белодробна болест).
В клинични проучвания на Exubera са регистрирани 6 наскоро диагностицирани случая на първични белодробни злокачествени заболявания сред пациенти, лекувани с Exubera, и 1 ново диагностициран случай сред пациенти, лекувани с сравнение. Има също 1 постмаркетингов доклад за първично белодробно злокачествено заболяване при пациент, лекуван с Exubera. В контролирани клинични проучвания на Exubera, честотата на нов първичен рак на белия дроб на 100 пациентски години излагане на лекарството е била 0,13 (5 случая над 3900 пациентски години) за пациенти, лекувани с Exubera, и 0,02 (1 случай над 4100 пациентски години) за пациенти, лекувани в сравнение. Имаше твърде малко случаи, за да се определи дали появата на тези събития е свързана с Exubera. Всички пациенти, диагностицирани с рак на белия дроб, са имали предишна анамнеза за пушене на цигари.
Горна част
предпазни мерки
Общ
Както при всички инсулинови препарати, времевият ход на действието на Exubera може да варира при различните индивиди или в различно време при един и същ индивид. Може да се наложи коригиране на дозата на всеки инсулин, ако пациентите променят физическата си активност или обичайния си хранителен план. Нуждите от инсулин могат да бъдат променени по време на интеркурентни състояния като болест, емоционални смущения или стрес.
Хипогликемията
Както при всички инсулинови препарати, хипогликемичните реакции могат да бъдат свързани с прилагането на Exubera. Бързите промени в серумните концентрации на глюкоза могат да предизвикат симптоми, подобни на хипогликемия при лица с диабет, независимо от стойността на глюкозата. Ранните предупредителни симптоми на хипогликемия могат да бъдат различни или по-слабо изразени при определени условия, като продължително продължителност на диабет, диабетно нервно заболяване, употреба на лекарства като бета-блокери или засилен контрол на диабета (виж МЕРКИ: Лекарствени взаимодействия). Такива ситуации могат да доведат до тежка хипогликемия (и евентуално загуба на съзнание) преди информираността на пациентите за хипогликемия.
Бъбречна недостатъчност
Не са провеждани проучвания при пациенти с бъбречно увреждане. Както при другите инсулинови препарати, изискванията за дозата при Exubera могат да бъдат намалени при пациенти с бъбречно увреждане (вж КЛИНИЧНА ФАРМАКОЛОГИЯ, Специални популации).
Чернодробно увреждане
Не са провеждани проучвания при пациенти с чернодробно увреждане. Както при други инсулинови препарати, изискванията за дозата на Exubera могат да бъдат намалени при пациенти с чернодробно увреждане (вж КЛИНИЧНА ФАРМАКОЛОГИЯ, Специални популации).
алергия
Системна алергия
В клиничните проучвания общата честота на алергичните реакции при пациенти, лекувани с Exubera, е подобна на тази при пациенти, използващи подкожни схеми с редовен човешки инсулин.
Както при другите инсулинови препарати, може да се появи рядка, но потенциално сериозна генерализирана алергия към инсулин, която може да причини обрив (включително сърбеж) по цялото тяло, задух, хрипове, намаляване на кръвното налягане, бърз пулс или изпотяване. Тежките случаи на генерализирана алергия, включително анафилактични реакции, могат да бъдат животозастрашаващи. Ако такива реакции възникнат от Exubera, Exubera трябва да бъде спрян и да се обсъдят алтернативни терапии.
Производство на антитела
Инсулиновите антитела могат да се развият по време на лечение с всички инсулинови препарати, включително Exubera. В клинични проучвания на Exubera, където сравнителят е подкожен инсулин, повишава нивата на инсулиновите антитела (както се отразява от анализи на активност за свързване на инсулин) са значително по-големи при пациенти, които са получавали Exubera, отколкото при пациенти, получаващи подкожен инсулин само. Не са установени клинични последици от тези антитела през периода на клиничните проучвания на Exubera; обаче дългосрочната клинична значимост на това увеличение на образуването на антитела е неизвестна.
дихателен
Белодробна функция
В клинични проучвания с продължителност до две години пациентите, лекувани с Exubera, демонстрират по-голям спад на белодробната функция, т.е. по-специално принудителният обем на издишване за една секунда (FEV1) и дифундиращият капацитет на въглеродния окис (DLCO), отколкото третиран в сравнение пациенти. Средната разлика в лечебната група в белодробната функция, която благоприятства групата за сравнение първите няколко седмици лечение с Exubera и не се променя през двугодишния период на лечение (Виж НЕЖЕЛАНИ РЕАКЦИИ: Белодробна функция).
По време на контролираните клинични изпитвания при отделни пациенти отделните пациенти са забелязали значително намаляване на белодробната функция и в двете терапевтични групи. Спад от изходната стойност на FEV1 от ¥ ¥ 20% при последно наблюдение се наблюдава при 1,5% от лекуваните с Exubera и 1,3% от пациентите, сравняващи сравнително лечение. Спад от DLCO от ‰ ¥ 20% при последно наблюдение се наблюдава при 5,1% от лекуваните с Exubera и 3,6% от пациентите, сравняващи сравнително лечение.
Поради ефекта на Exubera върху белодробната функция, всички пациенти трябва да имат оценка на спирометрията (FEV1) преди започване на терапия с Exubera. Оценка на DLCO трябва да се има предвид. Ефикасността и безопасността на Exubera при пациенти с изходен FEV1 или DLCO <70% прогнозирани не са установени и употребата на Exubera при тази популация не се препоръчва.
Препоръчва се оценка на белодробната функция (напр. Спирометрия) след първите 6 месеца от терапията и ежегодно след това дори при липса на белодробни симптоми. При пациенти, които имат спад от ‰ ¥ 20% от FEV1 от изходната стойност, тестовете за белодробна функция трябва да се повторят. Ако се потвърди decline ¥ 20% спад от изходната стойност на FEV1, Exubera трябва да се прекрати. Наличието на белодробни симптоми и по-слабото намаляване на белодробната функция може да изисква по-често наблюдение на белодробната функция и обмисляне на прекратяване на приема на Exubera.
Основна белодробна болест
Употребата на Exubera при пациенти с основно белодробно заболяване, като астма или ХОББ, не се препоръчва, тъй като ефикасността и безопасността на Exubera при тази популация не са установени.
бронхоспазъм
Рядко се съобщава за бронхоспазъм при пациенти, приемащи Exubera. Пациентите, които изпитват такава реакция, трябва да прекратят Exubera и незабавно да потърсят медицинска оценка. Повторното приложение на Exubera изисква внимателна оценка на риска и трябва да се извършва само при внимателно медицинско наблюдение с налични подходящи клинични условия.
Интеркурентна респираторна болест
Exubera се прилага при пациенти с интеркурентни респираторни заболявания (например бронхит, инфекции на горните дихателни пътища, ринит) по време на клинични проучвания. При пациенти, изпитващи тези състояния, 3-4% временно преустановяват терапията с Exubera. Няма повишен риск от хипогликемия или влошен гликемичен контрол при пациенти, лекувани с Exubera, в сравнение с пациенти, лекувани с подкожен инсулин. По време на интеркурентни респираторни заболявания може да се наложи внимателно проследяване на концентрациите на глюкоза в кръвта и коригиране на дозата.
Информация за пациенти
Пациентите трябва да бъдат инструктирани за процедури за самоуправление, включително мониторинг на глюкозата; правилна техника на вдишване Exubera; и хипогликемия и хипергликемия. Пациентите трябва да бъдат инструктирани за справяне със специални ситуации като интеркурентни състояния (болест, стрес или емоционални състояния) смущения), неадекватна или пропусната доза инсулин, невнимателно прилагане на повишена доза инсулин, недостатъчен прием на храна или пропуснати ястия.
Пациентите трябва да бъдат информирани, че при клинични проучвания лечението с Exubera е свързано с малки, непрогресиращи средни понижения на белодробната функция спрямо сравнителните лечения. Поради ефекта на Exubera върху белодробната функция, се препоръчват тестове за белодробна функция преди започване на лечение с Exubera. След започване на терапия се препоръчват периодични белодробни функционални тестове (вж МЕРКИ Дихателна, белодробна функция).
Пациентите трябва да информират своя лекар, ако имат анамнеза за белодробни заболявания, тъй като употребата на Exubera не се препоръчва при пациенти с основно белодробно заболяване (напр. астма или ХОББ) и е противопоказан при пациенти с лошо контролиран бял дроб заболяване.
Жените с диабет трябва да бъдат съветвани да информират своя лекар, ако са бременни или обмислят бременност.
Горна част
Взаимодействия с лекарства
Редица вещества влияят на глюкозния метаболизъм и може да изискват корекция на дозата инсулин и особено внимателно наблюдение.
По-долу са примери за вещества, които могат да намалят кръвния глюкоза понижаващ ефект на инсулин, който може да доведе до хипергликемия: кортикостероиди, даназол, диазоксид, диуретици, симпатомиметични средства (напр. епинефрин, албутерол, тербуталин), глюкагон, изониазид, фенотиазинови производни, соматропин, тиреоидни хормони, естрогени, прогестогени (напр. в орални контрацептиви), протеазни инхибитори и нетипични антипсихотични лекарства (например, оланзапин и клозапин).
Следват примери за вещества, които могат да повишат ефекта на инсулин за понижаване на кръвната захар и чувствителността към хипогликемия: перорално антидиабетни продукти, АСЕ инхибитори, дизопирамид, фибрати, флуоксетин, МАО инхибитори, пентоксифилин, пропоксифен, салицилати и сулфонамид антибиотици.
Бета-блокерите, клонидинът, литиевите соли и алкохолът могат или да увеличат, или да намалят ефекта на инсулина за понижаване на кръвната захар. Пентамидинът може да причини хипогликемия, която понякога може да бъде последвана от хипергликемия.
В допълнение, под въздействието на симпатолитични лекарствени продукти като бета-блокери, клонидин, гуанетидин и резерпин, признаците и симптомите на хипогликемия могат да бъдат намалени или да отсъстват.
Бронходилататорите и други инхалаторни продукти могат да променят абсорбцията на инхалирания човешки инсулин (вж КЛИНИЧНА ФАРМАКОЛОГИЯ, Специални популации). Препоръчват се последователни срокове на дозиране на бронходилататори по отношение на приложението на Exubera, внимателно проследяване на концентрациите на глюкоза в кръвта и титриране на дозата, според случая.
Канцерогенеза, мутагенеза, увреждане на плодовитостта
Двугодишни проучвания за канцерогенност при животни не са правени. Инсулинът не е мутагенен в теста за бактериална обратна мутация на Ames при наличие и отсъствие на метаболитна активация.
При плъхове Sprague-Dawley е проведено 6-месечно проучване за токсичност с многократна доза с инсулинов прах за инхалация в дози до 5,8 mg / kg / ден (в сравнение с клиничните начална доза от 0,15 mg / kg / ден, високата доза на плъхове е била 39 пъти или 8,3 пъти по-голяма от клиничната доза, базирана или на сравнение mg / kg или mg / m2 телесна повърхност). При маймуни на Cynomolgus беше проведено 6-месечно изследване за токсичност с многократна доза с инхалиран инсулин в дози до 0,64 mg / kg / ден. В сравнение с клиничната начална доза от 0,15 mg / kg / ден, високата доза на маймуната е 4,3 пъти или 1,4 пъти по-висока от клиничната доза въз основа на сравнение mg / kg или mg / m2 телесна повърхност. Това бяха максимално поносими дози на базата на хипогликемия.
В сравнение с контролните животни, не се наблюдават свързани с лечението нежелани ефекти върху двата вида върху белодробната функция, грубата или микроскопична морфология на дихателните пътища или бронхиалните лимфни възли. По подобен начин не е имало ефект върху индексите на клетъчната пролиферация в алвеоларната или бронхиоларната област на белия дроб и при двата вида.
Тъй като рекомбинантният човешки инсулин е идентичен с ендогенния хормон, проучвания за репродуктивност / фертилитет не са провеждани при животни.
бременност
Тератогенни ефекти
Бременност категория С
Не са провеждани проучвания за репродукция на животни с Exubera. Също така не е известно дали Exubera може да причини увреждане на плода, когато се прилага на бременна жена, или дали Exubera може да повлияе на репродуктивния капацитет. Exubera трябва да се дава на бременна жена, само ако това е ясно необходимо.
Кърмещи майки
Много лекарства, включително човешкият инсулин, се екскретират в кърмата. Поради тази причина трябва да се внимава, когато Exubera се прилага на кърмачка. Пациенти с диабет, които кърмят, може да се нуждаят от корекции в дозата на Exubera, схемата на хранене или и двете.
Педиатрична употреба
Дългосрочна безопасност и ефективност на Exubera при педиатрични пациенти не са установени (вж КЛИНИЧНА ФАРМАКОЛОГИЯ, Специални популации).
Гериатрична употреба
В контролирани фаза 2/3 клинични проучвания (n = 1975), Exubera се прилага на 266 пациенти на възраст 65 години и на 30 пациенти на възраст 75 години. По-голямата част от тези пациенти са имали диабет тип 2. Промяната в HbA1С и честотата на хипогликемия не се различава според възрастта.
Горна част
Нежелани реакции
Безопасността на Exubera самостоятелно или в комбинация с подкожен инсулин или перорални средства е била оценен при приблизително 2500 възрастни пациенти с диабет тип 1 или тип 2, които са били изложени на С EXUBERA. Приблизително 2000 пациенти са били изложени на Exubera за повече от 6 месеца, а повече от 800 пациенти са били изложени за повече от 2 години.
Нереспираторни нежелани събития
Нереспираторните нежелани събития, съобщени при ¥ ¥ 1% от пациентите, лекувани с Exubera, в контролирани фаза 2/3 клинични проучвания, независимо от причинно-следствената връзка, включват (но не се ограничават до) следните:
Метаболитни и хранителни вещества: хипогликемия (вж Предупреждения и МЕРКИ)
Тяло като цяло: болка в гърдите
Храносмилателна: сухота в устата
Специални сетива: отит (педиатрични диабетици тип 1)
Хипогликемията
Честотата и честотата на хипогликемия са сравними между Exubera и подкожен редовен човешки инсулин при пациенти с диабет тип 1 и тип 2. При пациенти тип 2, които не са били адекватно контролирани с единична перорална терапия, добавянето на Exubera е свързан с по-висок процент на хипогликемия, отколкото прибавянето на втори перорален прием агент.
Болка в гърдите
Редица различни гръдни симптоми се съобщават като нежелани реакции и са групирани под неспецифичния термин болка в гърдите. Тези събития се наблюдават при 4,7% от пациентите, лекувани с Exubera, и 3,2% от пациентите в сравнителни групи. По-голямата част (> 90%) от тези събития са съобщени за леки или умерени. Двама пациенти от Exubera и един от групата за сравняване прекратиха лечението поради болка в гърдите. Честотата на нежеланите събития, причинени от всички причинно-следствени заболявания, свързани с коронарна болест, като ангина пекторис или миокарден инфаркт, е сравнима в Exubera (0,7% ангина пекторис; 0,7% инфаркт на миокарда) и сравнител (1,3% ангина пекторис; 0,7% групи за лечение на миокарден инфаркт).
Суха уста
Съобщава се за сухота в устата при 2,4% от пациентите, лекувани с Exubera, и 0,8% от пациентите в сравнителни групи. Почти всички (> 98%) от съобщените сухота в устата са леки или умерени. Нито един пациент не е прекратил лечението поради сухота в устата.
Ушни събития при педиатрични диабетици
Педиатричните диабетици от тип 1 в групите Exubera изпитват нежелани събития, свързани с ухото, по-често, отколкото педиатричните диабетици тип 1 в лечебни групи, получаващи само подкожен инсулин. Тези събития включват отит (Exubera 6.5%; SC 3,4%), болка в ухото (Exubera 3,9%; SC 1,4%) и ушно разстройство (Exubera 1,3%; SC 0%).
Респираторни нежелани събития
Таблица 6 показва честотата на респираторните нежелани събития за всяка лечебна група, за които се съобщава в ¥% 1% от всяка терапевтична група в контролирани фаза 2 и 3 клинични проучвания, независимо от причинно-следствената връзка.
Таблица 6: Респираторни нежелани събития, докладвани в ¥ ¥ 1% от всяка лечебна група в контролирани фази 2 и 3 клинични изследвания, независимо от причинно-следствената връзка
| Процент от пациентите, докладващи събитие | |||||
|---|---|---|---|---|---|
| Нежелано събитие | Диабет тип 1 | Диабет тип 2 | |||
| EXUBERA, N = 698 |
SC N = 705 |
EXUBERA, N = 1279 |
SC N = 488 |
ОА N = 644 |
|
| SC = сравнителен подкожен инсулинов сравнител; OA = сравнителен агент за орални средства | |||||
| Инфекция на дихателните пътища | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Кашлицата увеличена | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| фарингит | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| ринит | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Синузит | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Дихателно разстройство | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| задух | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Храчките се увеличават | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| бронхит | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| астма | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| епистаксис | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| ларингит | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| пневмония | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Промяна на гласа | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
кашлица
В 3 клинични проучвания пациентите, попълнили въпросник за кашлица, съобщават, че кашлицата има тенденция да се проявява вътре секунди до минути след инхалацията на Exubera, беше предимно лека по тежест и рядко беше продуктивна при природата. Честотата на тази кашлица намалява при продължителна употреба на Exubera. В контролирани клинични проучвания 1,2% от пациентите са прекратили лечението с Exubera поради кашлица.
задух
Почти всички (> 97%) от задух са докладвани като леки или умерени. Малък брой пациенти, лекувани с Exubera (0,4%), преустановяват лечението поради диспнея в сравнение с 0,1% от пациентите, които са лекувани в сравнение.
Други респираторни нежелани реакции - фарингит, повишена храчка и епистаксис
Повечето от тези събития са докладвани като леки или умерени. Малък брой пациенти, лекувани с Exubera, преустановяват лечението поради фарингит (0,2%) и храчките се увеличават (0,1%); няма пациенти да преустановят лечението поради епистаксис.
Белодробна функция
Ефектът на Exubera върху дихателната система е оценен при над 3800 пациенти в контролирани фази 2 и 3 клинични проучвания (в които 1977 пациенти са лекувани с Exubera). В рандомизирани, открити клинични изпитвания с продължителност до две години, пациенти, лекувани с Exubera демонстрира по-голям спад на белодробната функция, по-специално принудителния обем на издишване в едно втори (FEV1) и дифундиращата способност на въглеродния окис (DL)CO), отколкото пациенти, лекувани в сравнение. Средните различия в лечебните групи при FEV1 и DLCO, са били отбелязани в рамките на първите няколко седмици на лечение с Exubera и не са прогресирали през двугодишния период на лечение. В едно завършено контролирано клинично проучване при пациенти с диабет тип 2 след две години лечение с Exubera, пациентите показват разделителна способност на разликата в лечебната група при FEV1 шест седмици след прекратяване на терапията. Резолюцията на ефекта на Exubera върху белодробната функция при пациенти с диабет тип 1 не е проучена след продължително лечение.
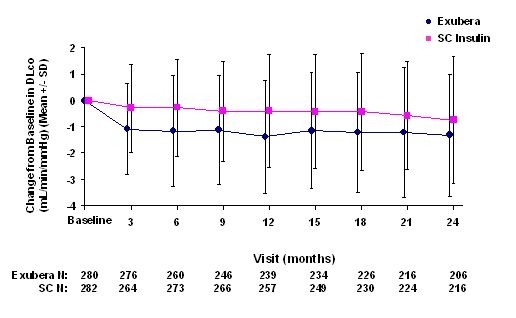
Фигури 3 до 6 показват средното FEV1 и DLCO промяна в сравнение с изходното време от две продължаващи рандомизирани, открити, двугодишни проучвания при 580 пациенти с тип 1 и 620 пациенти с диабет тип 2.
Фигура 3: Промяна от базовата стойност FEV1 (L) при пациенти с диабет тип 1 (средно +/- стандартно отклонение)
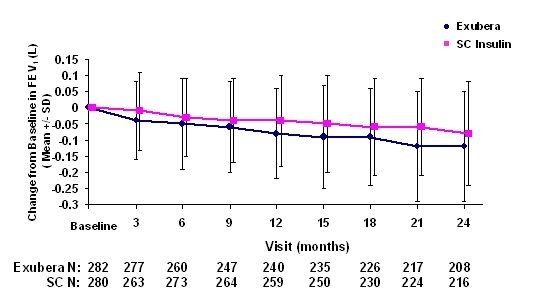
Фигура 4: Промяна от базовата стойност FEV1 (L) при пациенти с диабет тип 2 (средно +/- стандартно отклонение)
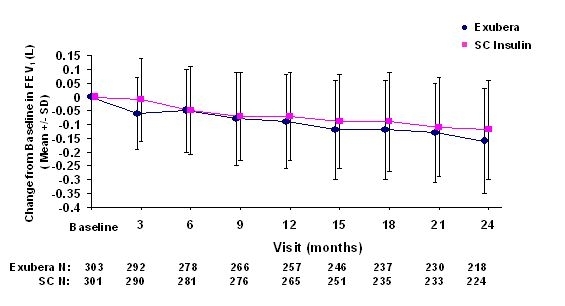
След 2 години лечение с Exubera при пациенти с диабет тип 1 и тип 2, разликата между терапевтичните групи средната промяна от изходната стойност на FEV1 е приблизително 40 ml, благоприятствайки за сравнение.
Фигура 5: Промяна от базова линия DLco (mL / min / mmHg) при пациенти с диабет тип 1 (средно +/- стандартно отклонение)
Фигура 6: Промяна от базовия DLco (mL / min / mmHg) при пациенти с диабет тип 2 (средно +/- стандартно отклонение)
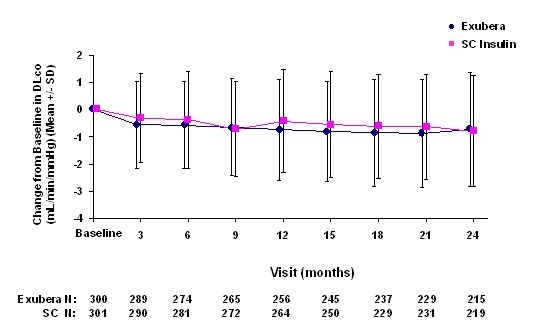
След 2 години от лечението с Exubera, разликата между лечебните групи за средната промяна от базовия DLCO е приблизително 0.5mL / min / mmHg (диабет тип 1), благоприятстващ сравнителя, и приблизително 0.1mL / min / mmHg (диабет тип 2), благоприятствайки Exubera.
По време на двугодишните клинични изпитвания при отделни пациенти отделните пациенти са забелязали значително намаляване на белодробната функция и в двете терапевтични групи. Спад от изходната стойност на FEV1 от ‰ ¥ 20% при последно наблюдение се наблюдава при 1,5% от лекуваните с Exubera и 1,3% от пациентите, които са били в сравнение. Спад от DLCO от ‰ ¥ 20% при последно наблюдение се наблюдава при 5,1% от лекуваните с Exubera и 3,6% от пациентите, сравняващи сравнително лечение.
Горна част
Предозирането
Хипогликемията може да възникне в резултат на излишък на инсулин спрямо приема на храна, енергийни разходи или и двете.
Леки до умерени епизоди на хипогликемия обикновено могат да бъдат лекувани с перорална глюкоза. Може да са необходими корекции в дозировката на лекарствата, моделите на хранене или упражненията.
Тежките епизоди на хипогликемия с кома, припадък или неврологично увреждане могат да бъдат лекувани с мускулно / подкожно глюкагон или концентрирана интравенозна глюкоза. Продължителен прием и наблюдение на въглехидрати може да се наложи, тъй като хипогликемия може да се повтори след очевидно клинично възстановяване.
Горна част
Дозировка и приложение
Exubera, подобно на бързодействащи инсулинови аналози, има по-бързо начало на понижаваща глюкозата активност в сравнение с подкожно инжектиран редовен човешки инсулин. Exubera има продължителност на понижаващата глюкозата активност, сравнима с подкожно инжектирания редовен човешки инсулин и по-дълга от бързодействащия инсулин. Дозите Exubera трябва да се прилагат непосредствено преди хранене (не повече от 10 минути преди всяко хранене).
При пациенти с диабет тип 1, Exubera трябва да се използва в схеми, които включват инсулин с по-продължително действие. За пациенти с диабет тип 2, Exubera може да се използва като монотерапия или в комбинация с перорални средства или инсулин с по-продължително действие.
Поради ефекта на Exubera върху белодробната функция, всички пациенти трябва да имат оценка на белодробната функция преди започване на терапия с Exubera. Препоръчва се периодично проследяване на белодробната функция при пациенти, лекувани с Exubera (вж МЕРКИ, Белодробна функция).
Exubera е предназначен за приложение чрез инхалация и трябва да се прилага само с помощта на Exubera® Инхалатор. Обърнете се към Ръководство за лекарства Exubera за описание на Exubera® Инхалатор и за инструкции как да използвате инхалатора.
Изчисляване на първоначалната доза преди хранене Exubera
Първоначалната доза Exubera трябва да бъде индивидуализирана и определена въз основа на съветите на лекаря в съответствие с нуждите на пациента. Препоръчителните начални дози преди хранене се основават на клинични изпитвания, при които пациентите са били помолени да ядат три хранения на ден. Първоначалните дози преди хранене могат да бъдат изчислени по следната формула: [телесно тегло (kg) X 0,05 mg / kg = доза преди хранене (mg)] закръглена надолу до най-близкото цяло число на милиграм (например, 3,7 mg закръглено надолу до 3 мг).
Приблизителни указания за първоначални дози Exubera преди хранене въз основа на телесното тегло на пациента са посочени в таблица 7:
Таблица 7: Приблизителни указания за първоначална доза преди хранене Exubera (въз основа на телесното тегло на пациента)
| Тегло на пациента (в кг) |
Тегло на пациента (в фунт) |
Първоначална доза за храна | Брой блистери от 1 mg на доза | Брой блистери от 3 mg на доза |
|---|---|---|---|---|
| 30 до 39,9 кг | 66 - 87 фунта | 1 mg на хранене | 1 | - |
| 40 до 59,9 кг | 88 - 132 фунта | 2 mg на хранене | 2 | - |
| 60 до 79,9 кг | 133 - 176 фунта | 3 mg на хранене | - | 1 |
| 80 до 99,9 кг | 177 - 220 фунта | 4 mg на хранене | 1 | 1 |
| 100 до 119,9 кг | 221 - 264 фунта | 5 mg на хранене | 2 | 1 |
| 120 до 139,9 кг | 265 - 308 фунта | 6 mg на хранене | - | 2 |
1 mg блистер от инсулиран инсулин Exubera е приблизително еквивалентен на 3 IU подкожно инжектиран редовен човешки инсулин. 3 mg блистер на инсулиран инсулин Exubera е приблизително еквивалентен на 8 IU подкожно инжектиран редовен човешки инсулин. Таблица 8 предоставя приблизителната IU доза от редовен подкожен човешки инсулин за дози инсулин с инхалатор Exubera от 1 mg до 6 mg.
Таблица 8: Приблизителна еквивалентна IU доза от редовен човешки подкожен инсулин за инсулирани дози Exubera дози от 1 mg до 6 mg
| Доза (mg) | Приблизителна редовна доза инсулин SC в IU | Брой блистери Exubera 1 mg на доза | Брой блистери Exubera 3 mg на доза |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Пациентите трябва да комбинират блистери от 1 mg и 3 mg, така че да се вземат най-малкоят брой блистери на доза (например, 4 mg доза трябва да се прилага като един 1 mg блистер и един 3 mg блистер). Последователното вдишване на три блистера с единична доза от 1 mg води до значително по-голяма експозиция на инсулин от вдишването на един блистер с единична доза от 3 mg. Следователно, три дози от 1 mg не трябва да бъдат заместени за една доза от 3 mg (вж КЛИНИЧНА ФАРМАКОЛОГИЯ, Фармакокинетика). Когато пациентът е стабилизиран в режим на дозиране, който включва 3 mg блистери и 3 mg блистери станат временно недостъпни, пациентът може временно да замести два 1 mg блистера с един 3 mg блистер. Кръвната глюкоза трябва да се следи отблизо.
Както при всички инсулини, и допълнителни фактори, които трябва да се вземат предвид при определяне на началната доза на Exubera, включват, но не се ограничават до текущия гликемичен контрол на пациента, предишния отговор на инсулина, продължителността на диабета, диетата и физическите упражнения навици.
Съображения за титруване на дозата
След започване на терапия с Exubera, както и при други средства за понижаване на глюкозата, може да се наложи корекция на дозата на базата на нужда на пациента (например концентрации на глюкоза в кръвта, размер на храненето и състав на хранителни вещества, време на деня и скорошни или очаквани упражнение). Всеки пациент трябва да бъде титруван до оптималната си доза въз основа на резултатите от мониторинга на кръвната захар.
Що се отнася до всички инсулини, времевият ход на действието на Exubera може да варира при различните индивиди или в различно време при един и същ индивид.
Exubera може да се използва по време на интеркурентни респираторни заболявания (например бронхит, инфекция на горните дихателни пътища, ринит). Може да се изисква стриктно наблюдение на концентрациите на глюкоза в кръвта и коригиране на дозата на индивидуална основа. Инхалаторни лекарствени продукти (напр. Бронходилататори) трябва да се прилагат преди прилагане на Exubera.
Горна част
Как се доставя
Exubera (човешки инсулин [rDNA произход]) Инхалационен прах се предлага в блистери с единична доза от 1 mg и 3 mg. Блистерите се разпределят върху перфорирани карти от шест блистера с единична доза (PVC / алуминий). Двете силни страни са диференцирани от цветен печат и тактилни марки, които могат да бъдат разграничени чрез допир. Блистерите от 1 mg и съответните перфорирани карти се отпечатват със зелено мастило, а картите са маркирани с една повдигната лента. Блистерите от 3 mg и съответните перфорирани карти са отпечатани със синьо мастило, а картите са маркирани с три повдигнати ленти.
Пет блистера са опаковани в прозрачна пластмасова (PET) термоформена тава. Всяка PET тава също съдържа изсушаващ препарат и е покрита с прозрачен пластмасов (PET) капак. Тавата с пет блистера (30 блистера с единична доза) е запечатана в торбичка от фолио с ламинат с десикант.
Exubera (човешки инсулин [произход на rDNA]) Блистери за вдишване на прах, Exubera® Инхалатор и заместител Exubera® Единиците за освобождаване са необходими за започване на терапия с Exubera и са предоставени в комплекта Exubera. Напълно сглобена Exubera® Инхалаторът се състои от базата на инхалатора, камера и Exubera® Освобождаване. Напълно сглобен инхалатор е снабден със заместваща камера и се предлага в комплекта Exubera и като отделна единица. Камарата се предлага и като индивидуален компонент.
EXUBERA,® Освобождаващи единици са индивидуално опаковани в запечатана термоформена тава. Една Exubera® Освобождаващото звено е включено във всеки напълно сглобен инхалатор. В комплекта Exubera и във всеки комбиниран пакет се предлагат две допълнителни издания. Единиците за издаване на Exubera също се предлагат индивидуално.
Вижте таблици 9 и 10 за описание на тези конфигурации.
Таблица 9
| Exubera (човешки инсулин [произход на rDNA]) Прахът за инхалация е наличен, както следва: | ||
|---|---|---|
| описание | съдържание | ЦДУ |
| Exubera KIT | 1 инхалатор Exubera 1 Резервна камера 1 mg ÷ 180 блистера 3 mg ≥ 90 блистера 2 Exubera® Освободете единици |
0069-0050-85 |
| Exubera Combination Pack 12 | 1 mg ≥ 90 блистера 3 mg ≥ 90 блистера 2 Exubera® Освободете единици |
0069-0050-19 |
| Exubera Combination Pack 15 | 1 mg ÷ 180 блистера 3 mg ≥ 90 блистера 2 Exubera® Освободете единици |
0069-0050-53 |
| Exubera 1 mg пациентен пакет | 90 — 1 mg 2 Exubera® Освободете единици |
0069-0707-37 |
| Exubera 3 mg пациентен пакет | 90 Ã 3 mg 2 Exubera® Освободете единици |
0069-0724-37 |
Таблица 10
| EXUBERA,® Инхалаторите и компонентите са налични, както следва: | ||
|---|---|---|
| описание | съдържание | ЦДУ |
| EXUBERA,® Инхалатор и камера | 1 Exubera® инхалатор 1 Резервна камера |
0069-0054-19 |
| EXUBERA,® Освободете единици | 2 Exubera® Освободете единици | 0069-0097-41 |
| EXUBERA,® камера | 1 Резервна камера | 0069-0061-19 |
Съхранение на блистер
Не се използва (неотворено): Да се съхранява при контролирана стайна температура, 25 ° C (77 ° F); разрешени екскурзии до 15-30 ° C (59-86 ° F) [виж USP контролирана температура в помещението]. Не замръзвайте. Да не се съхранява в хладилник.
При употреба: След отваряне на опаковката от фолио, блистерите с единична доза трябва да бъдат защитени от влага, съхранявани при 25 ° C (77 ° F); разрешени екскурзии до 15-30 ° C (59-86 ° F) [виж USP контролирана температура в помещението]. Не замръзвайте. Да не се съхранява в хладилник. Блистерите с единична доза трябва да се използват в рамките на 3 месеца след отваряне на фолиото. Върнете блистерите в опаковката, за да се предпазите от влага. Трябва да се внимава допълнително, за да се избегнат влажни среди, напр. парна баня след душ.
Изхвърлете блистера, ако е замразен.
Съхранение на инхалатора
Да се съхранява при контролирана стайна температура, 25 ° C (77 ° F); разрешени екскурзии до 15-30 ° C (59-86 ° F) [виж USP контролирана температура в помещението]. Не замръзвайте. Да не се съхранява в хладилник.
Ексберата® Инхалаторът може да се използва до 1 година от датата на първата употреба.
Замяна на Exubera® Освобождаване
Ексберата® Освобождаване на звено в Exubera® Инхалаторът трябва да се сменя на всеки 2 седмици.
Дръжте далеч от деца
Само Rx

LAB-0331-12.0
последна редакция 04/2008
Exubera, човешки инсулин [rDNA произход] Информация за пациента (на обикновен английски)
Подробна информация за признаците, симптомите, причините, лечението на диабета
Информацията в тази монография не е предназначена да обхване всички възможни употреби, указания, предпазни мерки, лекарствени взаимодействия или нежелани ефекти. Тази информация е обобщена и не е предназначена за конкретни медицински съвети. Ако имате въпроси относно лекарствата, които приемате или искате повече информация, консултирайте се с Вашия лекар, фармацевт или медицинска сестра.
обратно към: Прегледайте всички лекарства за диабет



