Янумет за лечение на диабет
Марка: Janumet
Общо наименование: Ситаглиптин и метформин хидрохлорид
Съдържание:
Показания и употреба
Дозировка и приложение
Форми и силни дози
Противопоказания
Предупреждения и предпазни мерки
Нежелани реакции
Взаимодействия с лекарства
Използване в специфични популации
свръх доза
описание
фармакология
Неклинична токсикология
Клинични изследвания
Как се доставя
Информация за консултации на пациентите
Janumet, Sitagliptin и Metformin Hydrochloride, Информация за пациента (на обикновен английски)
ВНИМАНИЕ: ЛАКТИЧНА Ацидоза
Млечната ацидоза е рядко, но сериозно усложнение, което може да възникне поради натрупване на метформин. Рискът се увеличава при състояния като сепсис, дехидратация, прекомерен прием на алкохол, чернодробна недостатъчност, бъбречно увреждане и остра застойна сърдечна недостатъчност.
Настъпването често е фино, придружено само от неспецифични симптоми като неразположение, миалгии, дихателен дистрес, нарастваща сънливост и неспецифичен коремен дистрес. Лабораторните аномалии включват ниско рН, увеличена празнина на аниони и повишен кръвен лактат.
Ако се подозира ацидоза, Janumet1 трябва да се прекрати и пациентът да бъде хоспитализиран незабавно. [Виж Предупреждения и предпазни мерки]
Показания и употреба
Janumet е показан като допълнение към диетата и упражненията за подобряване на гликемичния контрол при възрастни със захарен диабет тип 2, когато лечението както със ситаглиптин, така и с метформин е подходящо. [Виж Клинични изследвания.]
Важни ограничения при употреба
Janumet не трябва да се използва при пациенти с диабет тип 1 или за лечение на диабетна кетоацидоза, тъй като не би бил ефективен при тези условия.
Janumet не е проучван в комбинация с инсулин.
Горна част
Дозировка и приложение
Препоръчителна доза
Дозировката на антихипергликемичната терапия с Janumet трябва да бъде индивидуализирана въз основа на текущия режим на пациента, ефективност и поносимост, като същевременно не надвишават максималната препоръчителна дневна доза от 100 mg ситаглиптин и 2000 mg метформин. Първоначалната комбинирана терапия или поддържането на комбинирана терапия трябва да бъде индивидуализирана и оставена на преценката на лекуващия лекар.
Обикновено Janumet трябва да се дава два пъти дневно с хранене, с постепенно повишаване на дозата, за да се намалят стомашно-чревните (GI) странични ефекти поради метформин.
Началната доза на Janumet трябва да се основава на текущия режим на пациента. Janumet трябва да се прилага два пъти дневно с храна. Предлагат се следните дози:
50 mg ситаглиптин / 500 mg метформин хидрохлорид
50 mg ситаглиптин / 1000 mg метформин хидрохлорид.
Пациентите са недостатъчно контролирани само с диета и упражнения
Ако терапията с комбинирана таблетка, съдържаща ситаглиптин и метформин, се счита за подходяща за пациент със захарен диабет тип 2 при недостатъчен контрол само с диета и физически упражнения, препоръчителната начална доза е 50 mg ситаглиптин / 500 mg метформин хидрохлорид два пъти дневно. Пациентите с недостатъчен гликемичен контрол върху тази доза могат да бъдат титрирани до 50 mg ситаглиптин / 1000 mg метформин хидрохлорид два пъти дневно.
Пациентите са недостатъчно контролирани на монотерапия с метформин
Ако терапията с комбинирана таблетка, съдържаща ситаглиптин и метформин, се счита за подходяща за пациент, който не е достатъчно контролиран само на метформин, препоръчителната начална доза на Janumet трябва да осигурява ситаглиптин, дозиран като 50 mg два пъти дневно (100 mg обща дневна доза), а дозата метформин вече е взета. За пациенти, приемащи метформин 850 mg два пъти дневно, препоръчителната начална доза на Janumet е 50 mg ситаглиптин / 1000 mg метформин хидрохлорид два пъти дневно.
Пациентите са недостатъчно контролирани при монотерапия със ситаглиптин
Ако терапията с комбинирана таблетка, съдържаща ситаглиптин и метформин, се счита за подходяща за пациент неадекватно контролирана само на ситаглиптин, препоръчителната начална доза на Janumet е 50 mg ситаглиптин / 500 mg метформин хидрохлорид два пъти дневно. Пациентите с недостатъчен контрол върху тази доза могат да бъдат титрирани до 50 mg ситаглиптин / 1000 mg метформин хидрохлорид два пъти дневно. Пациентите, приемащи монотерапия със ситаглиптин, коригирана за бъбречна недостатъчност, не трябва да преминават към Janumet [вж. Противопоказания].
Пациенти, преминаващи от едновременно приложение на ситаглиптин и метформин
За пациенти, преминаващи от ситаглиптин, прилаган едновременно с метформин, може да се започне Janumet в дозата на ситаглиптин и метформин, който вече се приема.
Пациенти с недостатъчен контрол върху двойна комбинирана терапия с всеки от следните антихипергликемични средства: ситаглиптин, метформин или сулфонилурея
Ако при това се счита за подходяща терапия с комбинирана таблетка, съдържаща ситаглиптин и метформин обикновено, началната доза на Janumet трябва да осигурява ситаглиптин, дозиран като 50 mg два пъти дневно (общо 100 mg) дневна доза). При определяне на началната доза на компонента на метформин трябва да се вземе предвид нивото на гликемичен контрол на пациента и текущата доза (ако има такава) на метформин. Трябва да се има предвид постепенното повишаване на дозата за намаляване на стомашно-чревните (GI) странични ефекти, свързани с метформин. Пациентите, които са в момента или започват сулфонилурея, могат да изискват по-ниски дози на сулфонилурея, за да намалят риска от хипогликемия [вж. Предупреждения и предпазни мерки].
Не са провеждани проучвания, специално проучващи безопасността и ефикасността на Janumet при пациенти, лекувани преди това с други перорални антихипергликемични средства и преминали към Janumet. Всяка промяна в терапията на диабет тип 2 трябва да се предприеме с внимание и подходящо наблюдение, тъй като могат да настъпят промени в гликемичния контрол.
Горна част
Форми и силни дози
- Таблетките от 50 mg / 500 mg са светло розови, филмирани таблетки във формата на капсула, с надпис "575" от едната страна.
- 50 mg / 1000 mg таблетки са червени таблетки с форма на капсула с филмирани таблетки с надпис "577" от едната страна.
Горна част
Противопоказания
Янумет (ситаглиптин / метформин НС1) е противопоказан при пациенти с:
- Бъбречно заболяване или бъбречна дисфункция, например, както е предложено от нивата на креатинин в серума d ¥ 1,5 mg / dL [мъже], ¥ mg 1,4 mg / dL [жени] или ненормално креатининов клирънс, който също може да бъде резултат от състояния като сърдечно-съдов колапс (шок), остър миокарден инфаркт и септицемия [виж Предупреждения и предпазни мерки].
- Остра или хронична метаболитна ацидоза, включително диабетна кетоацидоза, със или без кома.
- История на сериозна реакция на свръхчувствителност към Janumet или ситаглиптин (един от компонентите на Janumet), като анафилаксия или ангиоедем. [Виж Предупреждения и предпазни мерки и Нежелани реакции.]
Janumet трябва временно да бъде прекратен при пациенти, подложени на рентгенологични изследвания, включващи интравазално прилагане на йодирани контрастни вещества, тъй като употребата на такива продукти може да доведе до остра промяна на бъбреците функция [виж Предупреждения и предпазни мерки].
Горна част
Предупреждения и предпазни мерки
Млечна ацидоза
Метформин хидрохлорид
Млечната ацидоза е рядко, но сериозно метаболитно усложнение, което може да възникне поради натрупване на метформин по време на лечението с Janumet; когато се появи, тя е фатална в приблизително 50% от случаите. Млечната ацидоза също може да се появи във връзка с редица патофизиологични състояния, включително захарен диабет и винаги, когато има значителна тъканна хипоперфузия и хипоксемия. Лактатната ацидоза се характеризира с повишени нива на лактат в кръвта (> 5 mmol / L), понижено pH на кръвта, електролитни нарушения с повишена анионна пропаст и повишено съотношение лактат / пируват. Когато метформин е замесен като причина за лактатна ацидоза, обикновено се откриват плазмени нива на метформин> 5 gg / mL.
Отчетената честота на лактатна ацидоза при пациенти, получаващи метформин хидрохлорид, е много ниска (приблизително 0,03 случая / 1000 пациентски години, с приблизително 0,015 смъртни случая / 1000 пациент-години). При повече от 20 000 пациент-годишни експозиции на метформин в клинични изпитвания няма съобщения за лактатна ацидоза. Съобщаваните случаи са възникнали предимно при пациенти с диабет със значима бъбречна недостатъчност, включително и двата присъщи бъбречни болест и бъбречна хипоперфузия, често при установяване на множество съпътстващи медицински / хирургични проблеми и множество съпътстващи медикаменти. Пациенти с застойна сърдечна недостатъчност, изискващи фармакологично лечение, по-специално тези с нестабилна или остра застойна сърдечна недостатъчност, които са изложени на риск от хипоперфузия и хипоксемия, са изложени на повишен риск от лактация ацидоза. Рискът от лактатна ацидоза се увеличава със степента на бъбречната дисфункция и възрастта на пациента. Следователно рискът от лактатна ацидоза може да бъде значително намален чрез редовно проследяване на бъбречната функция при пациенти, приемащи метформин и чрез използване на минималната ефективна доза метформин. По-специално, лечението на възрастни хора трябва да се придружава от внимателно наблюдение на бъбречната функция. Лечението с метформин не трябва да се започва при пациенти на възраст 80 години, освен ако не се измерва креатининовия клирънс показва, че бъбречната функция не се намалява, тъй като тези пациенти са по-податливи на развитие на лактатна ацидоза. В допълнение, метформин трябва незабавно да бъде отказан при наличие на някакво състояние, свързано с хипоксемия, дехидратация или сепсис. Тъй като нарушената чернодробна функция може значително да ограничи способността за изчистване на лактата, метформинът обикновено трябва да се избягва при пациенти с клинични или лабораторни данни за чернодробно заболяване. Пациентите трябва да бъдат предупредени срещу прекомерния прием на алкохол, или остър, или хроничен, когато приемат метформин, тъй като алкохолът усилва ефекта на метформин хидрохлорид върху метаболизма на лактат. В допълнение, метформин трябва временно да се прекрати преди всяко интраваскуларно радиоконтрастно изследване и за всяка хирургична процедура [вж. Предупреждения и предпазни мерки].
Началото на лактатната ацидоза често е фино и е придружено само от неспецифични симптоми като неразположение, миалгии, дихателен дистрес, нарастваща сънливост и неспецифичен коремен дистрес. Може да има свързана хипотермия, хипотония и резистентни брадиаритмии с по-изразена ацидоза. Пациентът и лекарят на пациента трябва да са наясно с възможната важност на подобни симптоми и пациентът трябва да бъде инструктиран да уведоми незабавно лекаря, ако се появят [виж Предупреждения и предпазни мерки]. Метформинът трябва да бъде изтеглен до изясняване на ситуацията. Серумните електролити, кетони, кръвна глюкоза и ако е указано, нивото на pH на кръвта, нивата на лактат и дори нивата на метформин в кръвта могат да бъдат полезни. След като пациентът е стабилизиран на всяко ниво на дозата метформин, стомашно-чревните симптоми, които са чести по време на започване на терапия, е малко вероятно да са свързани с лекарството. По-късното възникване на стомашно-чревни симптоми може да се дължи на лактатна ацидоза или друго сериозно заболяване.
Нивата на венозен плазмен лактат на гладно над горната граница на нормата, но по-малко от 5 mmol / L при пациенти, приемащи метформин, не са задължително да показват предстоящ лактат ацидоза и може да се обясни с други механизми, като лошо контролиран диабет или затлъстяване, енергична физическа активност или технически проблеми при боравене с проба [виж Предупреждения и предпазни мерки].
Млечна ацидоза трябва да се подозира при всеки пациент с диабет с метаболитна ацидоза, липсваща доказателства за кетоацидоза (кетонурия и кетонемия).
Млечната ацидоза е медицинска спешност, която трябва да се лекува в болнична обстановка. При пациент с млечна ацидоза, който приема метформин, лекарството трябва незабавно да бъде прекратено и незабавно да се предприемат общи поддържащи мерки. Тъй като метформин хидрохлорид може да се диализира (с клирънс до 170 мл / мин при добра хемодинамика състояния), препоръчва се бърза хемодиализа за коригиране на ацидозата и отстраняване на натрупаната метформин. Такова управление често води до бързо обръщане на симптомите и възстановяване [вж Противопоказания; Предупреждения и предпазни мерки].
Нарушена чернодробна функция
Тъй като нарушената чернодробна функция е свързана с някои случаи на лактатна ацидоза, Janumet обикновено трябва да се избягва при пациенти с клинични или лабораторни данни за чернодробно заболяване.
Оценка на бъбречната функция
Известно е, че метформинът и ситаглиптинът се екскретират значително от бъбреците. Рискът от натрупване на метформин и млечна ацидоза нараства със степента на увреждане на бъбречната функция. По този начин, пациентите със серумни нива на креатинин над горната граница на нормата за тяхната възраст не трябва да получават Janumet. При възрастни хора Janumet трябва внимателно да се титрува, за да се установи минималната доза за адекватен гликемичен ефект, тъй като остаряването може да бъде свързано с намалена бъбречна функция. [Виж Предупреждения и предпазни мерки и Използване в специфични популации.]
Преди започване на терапия с Janumet и поне веднъж годишно след това бъбречната функция трябва да бъде оценена и проверена като нормална. При пациенти, при които се очаква развитие на бъбречна дисфункция, особено при пациенти в напреднала възраст, бъбречни функцията трябва да се оценява по-често и Janumet да се прекрати, ако има данни за бъбречно увреждане настояще.
Витамин В12 нива
При контролирани клинични изпитвания на метформин с продължителност 29 седмици, понижение до субнормални нива на преди нормалния серумен витамин В12 нива, без клинични прояви, са наблюдавани при приблизително 7% от пациентите. Подобно намаление, вероятно поради намеса в B12 абсорбция от В12-интринен фактор комплекс, обаче, много рядко е свързан с анемия и изглежда бързо обратим с прекратяване на метформин или витамин В12 добавки. Ежегодно се препоръчва измерване на хематологичните параметри при пациенти на Janumet и всички видими аномалии трябва да бъдат подходящо изследвани и управлявани. [Виж Нежелани реакции.]
Някои хора (тези с недостатъчен витамин В12 или приемът или абсорбцията на калций) изглежда са предразположени към развитие на субнормален витамин В12 нива. При тези пациенти рутинен серумен витамин В12 измерванията на интервали от две до три години могат да бъдат полезни.
Прием на алкохол
Известно е, че алкохолът усилва ефекта на метформин върху метаболизма на лактата. Следователно пациентите трябва да бъдат предупредени срещу прекомерен прием на алкохол, остър или хроничен, докато получават Janumet.
Хирургични процедури
Използването на Janumet трябва временно да бъде спряно за всяка хирургична процедура (с изключение на незначителни процедури, които не са свързани с ограничен прием от храна и течности) и не трябва да се рестартира, докато пероралният прием на пациента не се възобнови и бъбречната функция не бъде оценена като нормалното.
Промяна в клиничния статус на пациенти с предишно контролиран диабет тип 2
Пациент с диабет тип 2, по-рано добре контролиран от Janumet, който развива лабораторни аномалии или клинични заболяване (особено неясно и лошо дефинирано заболяване) трябва да бъде оценено своевременно за доказателства за кетоацидоза или лактация ацидоза. Оценката трябва да включва нивата на серумните електролити и кетони, кръвната глюкоза и, ако е посочено, нивото на pH на кръвта, лактат, пируват и метформин. Ако се появи ацидоза на всяка от двете форми, Janumet трябва незабавно да бъде спрян и да се предприемат други подходящи коригиращи мерки.
Използвайте с лекарства, за които е известно, че причиняват хипогликемия
Ситаглипитн
Както е характерно за други антихипергликемични средства, използвани в комбинация със сулфонилурея, когато ситаглиптин е използван в комбинация с метформин и сулфонилурея, лекарство, за което се знае, че причинява хипогликемия, честотата на хипогликемия е увеличена спрямо тази на плацебо в комбинация с метформин и сулфонилурея [виж Нежелани реакции]. Следователно, пациентите, които също получават инсулинов секретагог (напр. Сулфонилурея, меглитинид), могат да изискват по-ниска доза от инсулиновия секретагог, за да намалят риска от хипогликемия [вж. Дозировка и приложение].
Метформин хидрохлорид
Хипогликемия не се наблюдава при пациенти, получаващи метформин самостоятелно при обичайни обстоятелства на употреба, но може да възникне, когато калоричният прием е дефицитен, когато упоритото упражнение не се компенсира от калорични добавки или по време на едновременна употреба с други средства за понижаване на глюкозата (като сулфонилуреи и инсулин) или етанол. Пациенти в напреднала възраст, инвалидизирани или недохранени и такива с надбъбречна или хипофизна недостатъчност или алкохолна интоксикация са особено податливи на хипогликемични ефекти. Хипогликемията може да бъде трудно разпознаваема при възрастни хора и при хора, които приемат блокиращи adre²-адренергични лекарства.
Съпътстващи медикаменти, засягащи бъбречната функция или разположение на метформин
Съпътстващи лекарства (и), които могат да повлияят на бъбречната функция или да доведат до значителна хемодинамична промяна или може пречат на разположението на метформин, като катионни лекарства, които се елиминират чрез бъбречна тубулна секреция [виж Взаимодействия с лекарства], трябва да се използва с повишено внимание.
Рентгенологични изследвания с интраваскуларни йодирани контрастни материали
Интраваскуларни контрастни изследвания с йодирани материали (например, венозна урограма, венозна холангиография, ангиография и компютърна томография (КТ) с интраваскуларни контрастни вещества) може да доведе до остра промяна на бъбречната функция и да е свързана с лактатна ацидоза при пациенти, получаващи метформин [вж. Противопоказания]. Следователно, при пациенти, при които се планира такова изследване, Janumet трябва временно да бъде прекратен по време на или преди процедура и се отказва в продължение на 48 часа след процедурата и се възстановява само след като бъбречната функция е преоценена и е установено, че бъди нормално.
Хипоксични състояния
Сърдечно-съдов колапс (шок) от каквато и да е причина, остра застойна сърдечна недостатъчност, остър миокарден инфаркт и други състояния, характеризиращи се с хипоксемия, са свързани с лактатна ацидоза и могат също да причинят преренална азотемия. Когато се появят такива събития при пациенти на терапия с Janumet, лекарството трябва незабавно да бъде прекратено.
Загуба на контрол на кръвната глюкоза
Когато пациент, стабилизиран във всеки диабетичен режим, е изложен на стрес като треска, травма, инфекция или операция, може да настъпи временна загуба на гликемичен контрол. В такива моменти може да се наложи отказ от Janumet и временно прилагане на инсулин. Janumet може да бъде възстановен след решаване на острия епизод.
Реакции на свръхчувствителност
Има постмаркетингови съобщения за сериозни реакции на свръхчувствителност при пациенти, лекувани със ситаглиптин, един от компонентите на Janumet. Тези реакции включват анафилаксия, ангиоедем и ексфолиативни състояния на кожата, включително синдром на Стивънс-Джонсън. Тъй като тези реакции се отчитат доброволно от популация с несигурен размер, обикновено това е не е възможно да се оцени надеждно тяхната честота или да се установи причинно-следствената връзка с експозицията на лекарства. Началото на тези реакции настъпва през първите 3 месеца след започване на лечение със ситаглиптин, като някои съобщения се появяват след първата доза. Ако се подозира реакция на свръхчувствителност, прекратете Janumet, преценете за други потенциални причини за събитието и започнете алтернативно лечение на диабет. [Виж Нежелани реакции.]
Макроваскуларни резултати
Няма клинични проучвания, установяващи категорични доказателства за намаляване на макроваскуларния риск с Janumet или друго лекарство против диабет.
Горна част
Нежелани реакции
Опит с клинични изпитвания
Тъй като клиничните изпитвания се провеждат при много различни условия, честотата на нежеланите реакции, наблюдавана в клиничните изпитвания на a лекарството не може да бъде сравнено директно с процентите в клиничните изпитвания на друго лекарство и може да не отразява честотата, наблюдавана при практикуват.
Съвместно приложение на ситаглиптин и метформин при пациенти с диабет тип 2, неадекватно контролирани при диета и упражнения
Таблица 1 обобщава най-често срещаните (‰ ¥ 5% от пациентите) нежелани реакции, докладвани (независимо от оценката на изследователя за причинно-следствената връзка) за 24 седмици плацебо-контролирано факторно проучване, при което ситаглиптин и метформин се прилагат едновременно на пациенти с диабет тип 2, неадекватно контролирани на диета и упражнения.
Таблица 1: Ситаглиптин и метформин, приложени едновременно на пациенти с диабет тип 2, при недостатъчен контрол върху диета и упражнения: нежелани реакции Отчетено (независимо от оценката на причинно-следствените изследвания) при ‰ ¥ 5% от пациентите, получаващи комбинирана терапия (и по-големи, отколкото при пациентите, получаващи Placebo) *
| Брой на пациентите (%) | ||||
Плацебо |
Ситаглипитн 100 mg QD |
Метформин 500 mg / Метформин наддаване 1000 mg†|
Ситаглипитн 50 mg оферта + Метформин 500 mg / Метформин наддаване 1000 mg†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| диария | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Инфекция на горните дихателни пътища | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| главоболие | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Ситаглиптин добавка терапия при пациенти с диабет тип 2, неадекватно контролирани върху метформин самостоятелно
В 24-седмично плацебо-контролирано проучване на 100 mg ситаглиптин, прилаган веднъж дневно, добавен към два пъти дневно метформин, не е имало съобщавани нежелани реакции, независимо от оценката на причинно-следствената връзка при in ¥ 5% от пациентите и по-често, отколкото при пациенти, плацебо. Прекъсването на терапията поради клинични нежелани реакции беше подобно на групата на лечение с плацебо (ситаглиптин и метформин, 1,9%; плацебо и метформин, 2,5%).
Хипогликемията
Нежеланите реакции на хипогликемия се основават на всички съобщения за хипогликемия; не се изисква едновременно измерване на глюкозата. Общата честота на предварително уточнените нежелани реакции на хипогликемия при пациенти с диабет тип 2, неадекватно контролирани на диета и физически упражнения, е била 0,6% при пациенти, които са получавали плацебо, 0,6% при пациенти, получавали само ситаглиптин, 0,8% при пациенти, получавали само метформин, и 1,6% при пациенти, получавали ситаглиптин в комбинация с метформин. При пациенти с диабет тип 2, недостатъчно контролирани само на метформин, общата честота на нежелани реакции реакциите на хипогликемия са били 1,3% при пациенти, получавали ситаглиптин и 2,1% при пациенти, които са получавали добавка плацебо.
Стомашно-чревни нежелани реакции
Честотата на предварително подбраните гастроинтестинални нежелани реакции при пациенти, лекувани със ситаглиптин и метформин, са подобни на тези, докладвани за пациенти, лекувани само с метформин. Вижте таблица 2.
Таблица 2: Предварително подбрани нежелани реакции на стомашно-чревния тракт (независимо от оценката на причинителя на изследващите), докладвани при пациенти с диабет тип 2, приемащи ситаглиптин и метформин.
| Брой на пациентите (%) | ||||||
| Проучване на ситаглиптин и метформин при пациенти, които не са достатъчно контролирани на диета и упражнения |
Проучване на добавката Sitagliptin при пациенти, които не са достатъчно контролирани върху Metformin Alone | |||||
Плацебо |
Ситаглипитн 100 mg QD |
Метформин 500 mg / Метформин наддаване 1000 mg* |
Ситаглипитн 50 mg оферта + Метформин 500 mg / Метформин наддаване 1000 mg* |
Плацебо и метформин ‰ mg 1500 mg дневно |
Ситаглиптин 100 mg QD и Метформин ‰ mg 1500 mg дневно |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| диария | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| гадене | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| повръщане | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Болка в корема†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Ситаглиптин в комбинация с метформин и глимепирид
В 24-седмично плацебо-контролирано проучване на 100 mg ситаглиптин като допълнителна терапия при пациенти с диабет тип 2, неадекватно контролирани на метформин и глимепирид (ситаглиптин, N = 116; плацебо, N = 113), докладваните нежелани реакции, независимо от оценката на причинителя за причинно-следствената връзка при ¥ ¥ 5% от пациентите лекувани със ситаглиптин и по-често, отколкото при пациенти, лекувани с плацебо, са: хипогликемия (ситаглиптин, 16.4%; плацебо, 0,9%) и главоболие (6,9%, 2,7%).
Не са наблюдавани клинично значими промени в жизнените показатели или в ЕКГ (включително в QTc интервала) при комбинация от ситаглиптин и метформин.
Най-често срещаният нежелан опит при монотерапия със ситаглиптин, отчитан независимо от изследователя оценка на причинно-следствената връзка при ¥ ¥ 5% от пациентите и по-често, отколкото при пациенти, получавали плацебо назофарингит.
Най-честите (> 5%) установени нежелани реакции поради започване на терапия с метформин са диария, гадене / повръщане, метеоризъм, коремен дискомфорт, лошо храносмилане, астения и главоболие.
Лабораторни тестове
Ситаглипитн
Честотата на лабораторните нежелани реакции е сходна при пациенти, лекувани със ситаглиптин и метформин (7,6%) в сравнение с пациенти, лекувани с плацебо и метформин (8,7%). В повечето, но не във всички проучвания, малко увеличение на броя на белите кръвни клетки (приблизително 200 клетки / микроL разлика в WBC спрямо плацебо; средна базова WBC около 6600 клетки / microL) се наблюдава поради малко увеличение на неутрофилите. Тази промяна в лабораторните параметри не се счита за клинично значима.
Метформин хидрохлорид
При контролирани клинични изпитвания на метформин с продължителност 29 седмици, понижение до субнормални нива на преди нормалния серумен витамин В12 нива, без клинични прояви, са наблюдавани при приблизително 7% от пациентите. Подобно намаление, вероятно поради намеса в B12 абсорбция от В12-интринен фактор комплекс, обаче, много рядко е свързан с анемия и изглежда бързо обратим с прекратяване на метформин или витамин В12 добавки. [Виж Предупреждения и предпазни мерки.]
Опит след постмаркетинг
Следните допълнителни нежелани реакции са установени по време на следприлагащата употреба на Janumet или ситаглиптин, един от компонентите на Janumet. Тъй като тези реакции се отчитат доброволно от популация с несигурен размер, обикновено това е не е възможно да се оцени надеждно тяхната честота или да се установи причинно-следствената връзка с експозицията на лекарства.
Реакциите на свръхчувствителност включват анафилаксия, ангиоедем, обрив, уртикария, кожен васкулит и ексфолиативни кожни състояния, включително синдром на Стивънс-Джонсън [виж Предупреждения и предпазни мерки]; инфекция на горните дихателни пътища; повишаване на чернодробния ензим; Панкреатит.
Горна част
Взаимодействия с лекарства
Катионни лекарства
Катионни лекарства (например, амилорид, дигоксин, морфин, прокаинамид, хинидин, хинин, ранитидин, триамтерен, триметоприм или ванкомицин), които са теоретично елиминираните чрез бъбречна тубулна секреция имат потенциал за взаимодействие с метформин, като се състезават за общ бъбречен тубуларен транспорт системи. Такова взаимодействие между метформин и перорален циметидин е наблюдавано при нормални здрави доброволци както с еднократна, така и с многократна доза метформин-циметидин проучвания за лекарствени взаимодействия, с 60% увеличение на пиковите плазмени концентрации на метформин и пълна кръв и 40% увеличение на метформин в плазма и пълна кръв AUC. Няма промени в елиминационния полуживот в проучването с еднократна доза. Метформин няма ефект върху фармакокинетиката на циметидин. Въпреки че подобни взаимодействия остават теоретични (с изключение на циметидин), внимателното наблюдение на пациента и коригиране на дозата на Janumet и / или интерфериращото лекарство се препоръчва при пациенти, които приемат катионни лекарства, които се екскретират чрез проксималната бъбречна тубуларна секретория система.
Дигоксин
Има леко увеличение на площта под кривата (AUC, 11%) и средна пикова концентрация на лекарството (Смакс, 18%) дигоксин при едновременно приложение на 100 mg ситаглиптин за 10 дни. Тези увеличения не се считат за клинично значими. Дигоксинът като катионно лекарство има потенциал да се конкурира с метформин за общи бъбречни тубуларни транспортни системи, като по този начин влияе върху серумните концентрации или на дигоксин, метформин или на двете. Пациентите, приемащи дигоксин, трябва да бъдат проследявани по подходящ начин. Не се препоръчва коригиране на дозата на дигоксин или Janumet.
глибурид
В едно проучване за взаимодействие с една доза при пациенти с диабет тип 2, едновременното приложение на метформин и глибурид не води до промени във фармакокинетиката на метформина или фармакодинамиката. Намалява AUC и C на глибуридмакс бяха наблюдавани, но бяха много променливи. Естествената доза на това проучване и липсата на корелация между нивата на глибурид в кръвта и фармакодинамичните ефекти правят клиничната значимост на това взаимодействие несигурна.
Фуроземид
Проучване за взаимодействие с лекарства с еднократна доза метформин-фуроземид при здрави индивиди показа, че фармакокинетичните параметри на двете съединения са повлияни от едновременното приложение. Фуроземид повишава плазмата на метформина и кръвната Смакс с 22% и AUC в кръвта с 15%, без значителна промяна в бъбречния клирънс на метформин. Когато се прилага с метформин, Смакс и AUC на фуроземид са съответно 31% и 12% по-малки, отколкото при самостоятелно приложение, и крайният полуживот е намален с 32%, без значителна промяна в фуроземид бъбрек клирънс. Няма налична информация за взаимодействието на метформин и фуросемид, когато се прилага едновременно хронично.
нифедипин
Проучване за взаимодействие с лекарства с еднократна доза метформин-нифедипин при нормални здрави доброволци показа, че едновременното приложение на нифедипин повишава плазмения метформин Смакс и AUC съответно с 20% и 9% и увеличават количеството, отделяно с урината. Tмакс и полуживотът не са засегнати. Изглежда, че нифедипин засилва абсорбцията на метформин. Метформинът имаше минимални ефекти върху нифедипин.
Употребата на метформин с други лекарства
Някои лекарства са склонни да произвеждат хипергликемия и могат да доведат до загуба на гликемичен контрол. Тези лекарства включват тиазидите и други диуретици, кортикостероиди, фенотиазини, продукти на щитовидната жлеза, естрогени, орални контрацептиви, фенитоин, никотинова киселина, симпатомиметици, лекарства, блокиращи калциевите канали, и изониазид. Когато такива лекарства се прилагат на пациент, приемащ Janumet, пациентът трябва да бъде внимателно наблюдаван, за да поддържа адекватен гликемичен контрол.
При здрави доброволци фармакокинетиката на метформин и пропранолол и метформин и ибупрофен не се повлиява при едновременно приложение в проучвания за взаимодействие с една доза.
Метформинът е незначително свързан с плазмените протеини и следователно е по-малко вероятно да взаимодейства със силно свързани с протеини лекарства като салицилати, сулфонамиди, хлорамфеникол и пробенецид в сравнение със сулфонилуреите, които са силно свързани със серума протеини.
Горна част
Използване в специфични популации
бременност
Категория Бременност:
Janumet
Няма адекватни и добре контролирани проучвания при бременни жени с Janumet или неговите отделни компоненти; следователно безопасността на Janumet при бременни жени не е известна. Janumet трябва да се използва по време на бременност, само ако е ясно необходимо.
Merck & Co., Inc. поддържа регистър за наблюдение на резултатите от бременността на жени, изложени на Janumet по време на бременност. Доставчиците на здравни грижи се насърчават да докладват за всяка пренатална експозиция на Janumet, като се обадят в Регистъра на бременността на (800) 986-8999.
Не са провеждани проучвания върху животни с комбинираните продукти в Janumet за оценка на ефектите върху репродукцията. Следващите данни се основават на открития в проучвания, проведени със ситаглиптин или метформин поотделно.
Ситаглипитн
Проведени са репродуктивни проучвания при плъхове и зайци. Дозите ситаглиптин до 125 mg / kg (приблизително 12 пъти по-голяма от експозицията при хора при максимална препоръчителна доза при хора) не влошават плодовитостта или не увреждат плода. Няма обаче адекватни и добре контролирани проучвания със ситаглиптин при бременни жени.
Ситаглиптин, прилаган на бременни женски плъхове и зайци от гестационен ден 6 до 20 (органогенеза), не е тератогенен при перорални дози до 250 mg / kg (плъхове) и 125 mg / kg (зайци), или приблизително 30 и 20 пъти излагане на хора при максимална препоръчителна доза при хора (MRHD) от 100 mg / ден на базата на AUC сравнения. По-високите дози увеличават честотата на малформации на ребрата при потомство при 1000 mg / kg или приблизително 100 пъти по-голяма експозиция при хора при MRHD.
Ситаглиптин, прилаган на женски плъхове от 6-ия ден на бременността до 21-ия лактационен ден, намалява телесното тегло при потомството на мъжки и женски животни с 1000 mg / kg. Не е наблюдавана функционална или поведенческа токсичност при потомство на плъхове.
Плацентарният трансфер на ситаглиптин, прилаган на бременни плъхове, е приблизително 45% на 2 часа и 80% на 24 часа след приема. Плацентарният трансфер на ситаглиптин, прилаган на бременни зайци, е приблизително 66% на 2 часа и 30% на 24 часа.
Метформин хидрохлорид
Метформинът не е тератогенен при плъхове и зайци в дози до 600 mg / kg / ден. Това представлява експозиция от около 2 и 6 пъти максималната препоръчителна дневна доза за човек от 2000 mg въз основа на сравненията на телесната повърхност съответно за плъхове и зайци. Определянето на феталните концентрации показа частична плацентарна бариера пред метформина.
Кърмещи майки
Не са провеждани проучвания при кърмещи животни с комбинираните компоненти на Janumet. В проучвания, проведени с отделните компоненти, ситаглиптин и метформин се секретират в млякото на кърмещи плъхове. Не е известно дали ситаглиптин се екскретира в кърмата. Тъй като много лекарства се екскретират в кърмата, трябва да се внимава, когато Janumet се прилага на кърмачка.
Педиатрична употреба
Безопасността и ефективността на Janumet при педиатрични пациенти под 18 години не са установени.
Гериатрична употреба
Janumet
Тъй като ситаглиптин и метформин се отделят значително от бъбреците и тъй като остаряването може да бъде свързано с намалена бъбречна функция, Janumet трябва да се използва с повишено внимание, тъй като възрастта се увеличава. Трябва да се внимава при подбора на дозата и трябва да се основава на внимателен и редовен мониторинг на бъбречната функция. [Виж Предупреждения и предпазни мерки; Клинична фармакология.]
Ситаглипитн
От общия брой на субектите (N = 3884) във фаза II и III клинични проучвания на ситаглиптин 725 пациенти са били на 65 и повече години, докато 61 пациенти са били на 75 и повече години. Не са наблюдавани общи разлики в безопасността или ефективността между субекти на възраст 65 години и повече и по-млади лица. Въпреки че този и друг докладван клиничен опит не са установили разлики в отговорите между възрастните и по-младите пациенти, по-голяма чувствителност на някои по-възрастни хора не може да бъде изключен.
Метформин хидрохлорид
Контролираните клинични изследвания на метформин не включват достатъчен брой пациенти в напреднала възраст, за да се определи дали те реагират различно от по-млади пациенти, въпреки че други съобщени клинични опит не са установили разлики в отговорите между възрастни и млади пациенти. Метформин трябва да се използва само при пациенти с нормална бъбречна функция. Първоначалната и поддържаща доза на метформин трябва да бъде консервативна при пациенти в напреднала възраст поради потенциала за намаляване на бъбречната функция при тази популация. Всяка корекция на дозата трябва да се основава на внимателна оценка на бъбречната функция. [Виж Противопоказания; Предупреждения и предпазни мерки; и Клинична фармакология.]
Горна част
свръх доза
Ситаглипитн
По време на контролирани клинични изпитвания при здрави индивиди се прилагат единични дози до 800 mg ситаглиптин. Максимално средно повишение на QTc от 8,0 msec е наблюдавано при едно проучване при доза от 800 mg ситаглиптин, среден ефект, който не се счита за клинично важен [вж. Клинична фармакология]. Няма опит с дози над 800 mg при хора. В проучвания с многодозова фаза I не са наблюдавани свързани с дозата клинични нежелани реакции при ситаглиптин с дози до 400 mg на ден за периоди до 28 дни.
В случай на предозиране е разумно да се използват обичайните поддържащи мерки, например да се премахне неусвоен материал от стомашно-чревния тракт тракт, използвайте клиничен мониторинг (включително получаване на електрокардиограма) и да започнете поддържаща терапия, както е указано от клиничния пациент статус.
Ситаглиптин се диализира умерено. При клинични проучвания приблизително 13,5% от дозата се отстранява в продължение на 3- до 4-часова сесия на хемодиализа. Продължителната хемодиализа може да се обмисли, ако е клинично подходяща. Не е известно дали ситаглиптин може да се диализира чрез перитонеална диализа.
Метформин хидрохлорид
Настъпило е предозиране на метформин хидрохлорид, включително поглъщане на количества над 50 грама. Хипогликемия се съобщава в приблизително 10% от случаите, но не е установена причинно-следствена връзка с метформин хидрохлорид. Съобщава се за лактатна ацидоза в приблизително 32% от случаите на предозиране с метформин [вж Предупреждения и предпазни мерки]. Метформин може да се диализира с клирънс до 170 mL / min при добри хемодинамични условия. Следователно хемодиализата може да бъде полезна за отстраняване на натрупаното лекарство от пациенти, при които се подозира предозиране на метформин.
Горна част
описание
Таблетките Janumet (ситаглиптин / метформин НС1) съдържат две перорални антихипергликемични лекарства, използвани за лечение на диабет тип 2: ситаглиптин и метформин хидрохлорид.
Ситаглипитн
Ситаглиптин е орално активен инхибитор на ензима дипептидил пептидаза-4 (DPP-4). Ситаглиптин присъства в таблетки Janumet под формата на ситаглиптин фосфат монохидрат. Ситаглиптин фосфат монохидрат се описва химически като 7 - [(3R) - 3 - амино - 1 - оксо - 4 - (2,4,5 - трифлуорофенил) бутил] - 5,6,7,8 - тетрахидро - 3 - (трифлуорометил) - 1,2,4 - триазоло [4,3 - а] пиразин фосфат (1: 1) монохидрат с емпирична формула от С16Н15F6н5О-Н3PO4-Н2О и молекулно тегло 523,32. Структурната формула е:
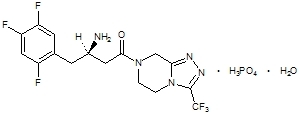
Ситаглиптин фосфат монохидратът е бял до почти бял, кристален, нехигроскопичен прах. Той е разтворим във вода и N, N-диметилформамид; слабо разтворим в метанол; много слабо разтворим в етанол, ацетон и ацетонитрил; и неразтворим в изопропанол и изопропилацетат.
Метформин хидрохлорид
Метформин хидрохлорид (N, N-диметилимидодикарбонимидиев диамид хидрохлорид) не е химически или фармакологично свързан с други класове перорални антихипергликемични средства. Метформин хидрохлорид е бяло до почти бяло кристално съединение с молекулна формула С4Н11н5-HCl и молекулно тегло от 165.63. Метформин хидрохлорид е свободно разтворим във вода и е практически неразтворим в ацетон, етер и хлороформ. PKа на метформин е 12,4. PH на 1% воден разтвор на метформин хидрохлорид е 6,68. Структурната формула е както е показано:
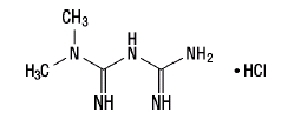
Janumet
Janumet се предлага за перорално приложение като таблетки, съдържащи 64,25 mg ситаглиптин фосфат монохидрат и еквивалент на метформин хидрохлорид до: 50 mg ситаглиптин като свободна база и 500 mg метформин хидрохлорид (Janumet 50 mg / 500 mg) или 1000 mg метформин хидрохлорид (Janumet 50 mg / 1000 мг). Всяка филмирана таблетка на Janumet съдържа следните неактивни съставки: микрокристална целулоза, поливинилпиролидон, натриев лаурил сулфат и натриев стеарил фумарат. Освен това филмовото покритие съдържа следните неактивни съставки: поливинил алкохол, полиетилен гликол, талк, титанов диоксид, червен железен оксид и черен железен оксид.
Горна част
Клинична фармакология
Механизъм на действие
Janumet
Janumet комбинира два антихипергликемични средства с допълнителни механизми на действие за подобряване на гликемичния контрол при пациенти с диабет тип 2: ситаглиптин, инхибитор на дипептидил пептидаза-4 (DPP-4) и метформин хидрохлорид, член на бигуанида клас.
Ситаглипитн
Ситаглиптин е инхибитор на DPP-4, който се смята, че упражнява действията си при пациенти с диабет тип 2, като забавя инактивирането на инкретиновите хормони. Концентрациите на активните интактни хормони се повишават от ситаглиптин, като по този начин се увеличава и удължава действието на тези хормони. Инкретин хормони, включително глюкагоноподобен пептид-1 (GLP-1) и инсулинотропни, зависещи от глюкоза полипептид (GIP), се отделят от червата през целия ден и нивата се повишават в отговор до хранене. Тези хормони бързо се инактивират от ензима DPP-4. Инкретините са част от ендогенна система, участваща във физиологичната регулация на глюкозната хомеостаза. Когато концентрациите на глюкоза в кръвта са нормални или повишени, GLP-1 и GIP увеличават синтеза на инсулин и се освобождават от бета-клетките на панкреаса чрез вътреклетъчни сигнални пътища, включващи цикличен AMP. GLP-1 също намалява секрецията на глюкагон от алфа клетките на панкреаса, което води до намаляване на чернодробната глюкоза. Чрез повишаване и удължаване на нивата на активен инкретин ситаглиптин увеличава отделянето на инсулин и намалява нивата на глюкагон в кръвообращението по глюкозозависим начин. Ситаглиптин демонстрира селективност за DPP-4 и не инхибира активността на DPP-8 или DPP-9 in vitro при концентрации, приблизителни на тези от терапевтичните дози.
Метформин хидрохлорид
Метформин е антихипергликемично средство, което подобрява глюкозния толеранс при пациенти с диабет тип 2, като понижава базалната и постпрандиалната плазмена глюкоза. Неговите фармакологични механизми на действие са различни от другите класове перорални антихипергликемични средства. Метформинът намалява чернодробната глюкоза, намалява чревната абсорбция на глюкоза и подобрява чувствителността към инсулин чрез увеличаване на периферното усвояване и използване на глюкозата. За разлика от сулфонилуреите, метформинът не предизвиква хипогликемия нито при пациенти с диабет тип 2, нито при нормални пациенти (освен при специални обстоятелства [вж. Предупреждения и предпазни мерки]) и не предизвиква хиперинсулинемия. С терапията с метформин секрецията на инсулин остава непроменена, докато нивата на инсулин на гладно и целодневният плазмен отговор на инсулин всъщност могат да намалят.
12.2. Фармакодинамика
Ситаглипитн
Общ
При пациенти с диабет тип 2, прилагането на ситаглиптин води до инхибиране на активността на ензима DPP-4 за период от 24 часа. След перорално натоварване с глюкоза или хранене, това инхибиране на DPP-4 доведе до 2- до 3-кратно увеличение на циркулиращите нива на активни GLP-1 и GIP, намалени концентрации на глюкагон и повишена отзивчивост на освобождаването на инсулин към глюкоза, което води до по-високи С-пептиди и инсулин концентрации. Повишаването на инсулина с понижаването на глюкагона се свързва с по-ниски концентрации на глюкоза на гладно и намалена екскурзия на глюкоза след перорално натоварване с глюкоза или хранене.
Съвместно приложение на ситаглиптин и метформин хидрохлорид
В двудневно проучване при здрави индивиди, само ситаглиптин повишава активните концентрации на GLP-1, докато самият метформин повишава активните и общите концентрации на GLP-1 до подобни екстензиви. Едновременното приложение на ситаглиптин и метформин има адитивен ефект върху активните концентрации на GLP-1. Ситаглиптин, но не метформин, повишава активните GIP концентрации. Не е ясно какво означават тези открития за промените в гликемичния контрол при пациенти с диабет тип 2.
В проучвания със здрави индивиди ситаглиптин не понижава кръвната глюкоза или не предизвиква хипогликемия.
Сърдечна електрофизиология
В рандомизирано, плацебо-контролирано кръстосано проучване, 79 здрави индивиди са прилагани еднократна перорална доза ситаглиптин 100 mg, ситаглиптин 800 mg (8 пъти повече от препоръчителната доза) и плацебо. При препоръчителната доза от 100 mg не е имало ефект върху QTc интервала, получен при пиковата плазмена концентрация или по всяко друго време по време на изследването. След дозата от 800 mg, максималното увеличение на плацебо-коригираната средна промяна на QTc от изходната стойност на 3 часа след дозата е 8,0 msec. Това увеличение не се счита за клинично значимо. При доза от 800 mg пиковите плазмени концентрации на ситаглиптин бяха приблизително 11 пъти по-високи от пиковите концентрации след доза от 100 mg.
При пациенти с диабет тип 2, прилаган ситаглиптин 100 mg (N = 81) или ситаглиптин 200 mg (N = 63) дневно, не са имали смислени промени в QTc интервала на базата на данни от ЕКГ, получени по време на очакваната пикова плазма концентрация.
Фармакокинетика
Janumet
Резултатите от проучване за биоеквивалентност при здрави индивиди показват, че Janumet (ситаглиптин / метформин НС1) 50 mg / 500 mg и 50 mg / 1000 mg комбинирани таблетки са биоеквивалентни при едновременно приложение на съответните дози ситаглиптин (JANUVIA™2) и метформин хидрохлорид като индивидуални таблетки.
абсорбция
Ситаглипитн
Абсолютната бионаличност на ситаглиптин е приблизително 87%. Едновременното приложение на храна с високо съдържание на мазнини със ситаглиптин няма ефект върху фармакокинетиката на ситаглиптин.
Метформин хидрохлорид
Абсолютната бионаличност на 500 mg mg метформин хидрохлорид, дадена при гладуване, е приблизително 50-60%. Изследвания, използващи единични перорални дози таблетки метформин хидрохлорид 500 mg до 1500 mg и 850 mg до 2550 mg, показват, че има липса на пропорционалност на дозата с увеличаване на дозите, което се дължи на намалена абсорбция, а не промяна в елиминирането. Храната намалява степента и леко забавя абсорбцията на метформин, както се вижда от приблизително 40% по-ниска средна пикова плазмена концентрация (Cмакс), 25% по-ниска площ под плазмената концентрация спрямо кривата на времето (AUC) и 35-минутно удължаване на времето до пикова плазмена концентрация (Tмакс) след прилагане на една 850 mg mg таблетка метформин с храна, в сравнение със същата сила на таблетката, приложена на гладно. Клиничното значение на тези понижения не е известно.
разпределение
Ситаглипитн
Средният обем на разпределение в стационарно състояние след еднократна интравенозна доза от 100 mg ситаглиптин на здрави индивиди е приблизително 198 литра. Фракцията на ситаглиптин, обратимо свързана с плазмените протеини, е ниска (38%).
Метформин хидрохлорид
Очевидният обем на разпределение (V / F) на метформин след единични перорални дози таблетки метформин хидрохлорид 850 mg средно 654 ± 358 L. Метформинът е незначително свързан с плазмените протеини, за разлика от сулфонилуреите, които са свързани повече от 90% протеин. Метформиновите дялове в еритроцитите, най-вероятно като функция на времето. При обичайни клинични дози и схеми на дозиране на метформин хидрохлорид, стационарни плазмени концентрации на метформин се достигат в рамките на 24-48 часа и обикновено
метаболизъм
Ситаглипитн
Приблизително 79% от ситаглиптин се екскретира непроменен с урината, като метаболизмът е незначителен път на елиминиране.
След [14С] перорална доза ситаглиптин, приблизително 16% от радиоактивността се отделя като метаболити на ситаглиптин. Шест метаболита бяха открити при следи и не се очаква да допринесат за плазмената инхибиторна активност на ситаглиптин. Проучванията in vitro показват, че основният ензим, отговорен за ограничения метаболизъм на ситаглиптин, е CYP3A4, с принос от CYP2C8.
Метформин хидрохлорид
Интравенозните проучвания за еднократна доза при нормални индивиди показват, че метформинът се екскретира непроменен при урина и не се подлага на чернодробен метаболизъм (не са установени метаболити при хора), нито жлъчни екскреция.
отделяне
Ситаглипитн
След прилагане на перорално [14C] доза ситаглиптин за здрави индивиди, приблизително 100% от прилаганата радиоактивност се елиминира в изпражненията (13%) или урината (87%) в рамките на една седмица след приема. Привидният терминал t1/2 след 100 mg перорална доза ситаглиптин е приблизително 12,4 часа, а бъбречният клирънс е приблизително 350 ml / min.
Елиминирането на ситаглиптин става предимно чрез бъбречна екскреция и включва активна тубулна секреция. Ситаглиптин е субстрат за човешки органичен анионен транспортер-3 (hOAT-3), който може да участва в бъбречното елиминиране на ситаглиптин. Клиничното значение на hOAT-3 при транспортиране на ситаглиптин не е установено. Ситаглиптинът е също субстрат на р-гликопротеин, който също може да участва в медиирането на бъбречното елиминиране на ситаглиптин. Циклоспоринът, обаче, инхибитор на р-гликопротеин, не намалява бъбречния клирънс на ситаглиптин.
Метформин хидрохлорид
Бъбречният клирънс е приблизително 3,5 пъти по-голям от креатининовия клирънс, което показва, че тръбната секреция е основният път на елиминиране на метформин. След перорално приложение приблизително 90% от абсорбираното лекарство се елиминира през бъбречния път в рамките на първите 24 часа, като плазменият полуживот елиминира приблизително 6,2 часа. В кръвта елиминационният полуживот е приблизително 17,6 часа, което предполага, че еритроцитната маса може да бъде отделение за разпределение.
Специални популации
Бъбречна недостатъчност
Janumet
Janumet не трябва да се прилага при пациенти с бъбречна недостатъчност [виж Противопоказания; Предупреждения и предпазни мерки].
Ситаглипитн
Наблюдава се приблизително 2-кратно повишаване на плазмената AUC на ситаглиптин при пациенти с умерена бъбречна недостатъчност и приблизително 4-кратно увеличение се наблюдава при пациенти с тежка бъбречна недостатъчност, включително пациенти с ESRD на хемодиализа в сравнение с нормалния здрав контрол субекти.
Метформин хидрохлорид
При пациенти с намалена бъбречна функция (въз основа на измерен клирънс на креатинин), плазменият и кръвния полуживот на метформин се удължава и бъбречният клирънс се намалява пропорционално на намаляването на креатинина клирънс.
Чернодробна недостатъчност
Ситаглипитн
При пациенти с умерена чернодробна недостатъчност (оценка на Child-Pugh от 7 до 9) средните AUC и Cмакс на ситаглиптин се увеличава съответно приблизително 21% и 13%, в сравнение със здравословно съчетани контроли след прилагане на единична доза от 100 mg ситаглиптин. Тези разлики не се считат за клинично значими.
Няма клиничен опит при пациенти с тежка чернодробна недостатъчност (оценка на Child-Pugh> 9).
Метформин хидрохлорид
Не са провеждани фармакокинетични проучвания на метформин при пациенти с чернодробна недостатъчност.
пол
Ситаглипитн
Полът няма клинично значим ефект върху фармакокинетиката на ситаглиптин на базата на композит анализ на фармакокинетичните данни на фаза I и на популационен фармакокинетичен анализ на фаза I и фаза II данни.
Метформин хидрохлорид
Фармакокинетичните параметри на метформин не се различават значително между нормалните индивиди и пациенти с диабет тип 2, когато са анализирани според пола. По подобен начин при контролирани клинични проучвания при пациенти с диабет тип 2 антихипергликемичният ефект на метформин е съпоставим при мъже и жени.
Гериатрична
Ситаглипитн
Когато се вземат предвид ефектите на възрастта върху бъбречната функция, само възрастта не е била клинично значимо въздействие върху фармакокинетиката на ситаглиптин на базата на популационна фармакокинетика анализ. Пациентите в напреднала възраст (65 до 80 години) имат приблизително 19% по-високи плазмени концентрации на ситаглиптин в сравнение с по-младите.
Метформин хидрохлорид
Ограничените данни от контролирани фармакокинетични проучвания на метформин при здрави пациенти в напреднала възраст показват, че общият плазмен клирънс на метформин е намален, полуживотът се удължава и Cмакс се увеличава в сравнение със здрави млади субекти. От тези данни се вижда, че промяната във фармакокинетиката на метформин със стареене се дължи основно на промяна в бъбречната функция (виж GLUCOPHAGE3 информация за предписване: КЛИНИЧНА ФАРМАКОЛОГИЯ, Специални популации, гериатрия).
Лечението с Janumet не трябва да се започва при пациенти на възраст 80 години, освен ако измерването на креатининовия клирънс не покаже, че бъбречната функция не е намалена [вж. Предупреждения и предпазни мерки].
Педиатрична
Не са провеждани проучвания с Janumet при педиатрични пациенти.
раса
Ситаглипитн
Раса няма клинично значим ефект върху фармакокинетиката на ситаглиптин въз основа на композитен анализ от наличните фармакокинетични данни, включително теми от бяло, испаномовно, черно, азиатско и друго расово групи.
Метформин хидрохлорид
Не са провеждани проучвания на фармакокинетичните параметри на метформин според расата. При контролирани клинични проучвания на метформин при пациенти с диабет тип 2, антихипергликемичният ефект е съпоставим при белите (n = 249), черните (n = 51) и испаноядрените (n = 24).
Индекс на телесна маса (ИТМ)
Ситаглипитн
Индексът на телесната маса няма клинично значим ефект върху фармакокинетиката на ситаглиптин на базата на композит анализ на фармакокинетичните данни на фаза I и на популационен фармакокинетичен анализ на фаза I и фаза II данни.
Взаимодействия с лекарства
Ситаглиптин и Метформин хидрохлорид
Съвместното приложение на множество дози ситаглиптин (50 mg) и метформин (1000 mg), дадени два пъти дневно, направи не променя смислено фармакокинетиката на ситаглиптин или метформин при пациенти с тип 2 диабет.
Не са провеждани проучвания за фармакокинетично лекарствено взаимодействие с Janumet; Въпреки това, такива изследвания са проведени с отделните компоненти на Janumet (ситаглиптин и метформин хидрохлорид).
Ситаглипитн
In vitro оценка на лекарствените взаимодействия
Ситаглиптин не е инхибитор на CYP изозими CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 или 2B6 и не е индуктор на CYP3A4. Ситаглиптин е р-гликопротеинов субстрат, но не инхибира транспортирания от дигоксин р-гликопротеин. Въз основа на тези резултати се смята, че ситаглиптинът няма вероятност да предизвика взаимодействие с други лекарства, които използват тези пътища.
Ситаглиптин не се свързва в голяма степен с плазмените протеини. Следователно склонността на ситаглиптин да участва в клинично значими взаимодействия лекарство-лекарство, медиирани от изместване на плазмените протеини, е много ниска.
In vivo Оценка на лекарствените взаимодействия
Ефект на Ситаглиптин върху други лекарства
В клиничните проучвания, както е описано по-долу, ситаглиптин не променя значимо фармакокинетиката на метформин, глибурид, симвастатин, розиглитазон, варфарин или перорално. контрацептиви, предоставящи in vivo доказателства за ниска склонност за предизвикване на лекарствени взаимодействия със субстрати на CYP3A4, CYP2C8, CYP2C9 и органичен катионен транспортер (ОСТ).
Дигоксин: Ситаглиптин има минимален ефект върху фармакокинетиката на дигоксин. След прилагане на 0,25 mg дигоксин едновременно със 100 mg ситаглиптин дневно в продължение на 10 дни, плазмената AUC на дигоксин се повишава с 11%, а плазмата Смакс с 18%.
Сулфонилуреи: Фармакокинетиката на глибурид, еднократна доза, субстрат на CYP2C9, не се променя по значимост при субекти, получаващи множество дози ситаглиптин. Не се очаква клинично значими взаимодействия с други сулфонилуреи (напр. Глипизид, толбутамид и глимепирид), които, подобно на глибурид, се елиминират предимно от CYP2C9 [виж Предупреждения и предпазни мерки].
Симвастатин: Фармакокинетиката на еднократна доза на симвастатин, субстрат на CYP3A4, не се променя значимо при субекти, получаващи множество дневни дози ситаглиптин. Следователно ситаглиптин не е инхибитор на метаболизма, медииран от CYP3A4.
Тиазолидиндиони: Фармакокинетиката на еднократна доза на розиглитазон не се променя значимо при субекти приемане на множество дневни дози ситаглиптин, което показва, че ситаглиптин не е инхибитор на CYP2C8-медииран метаболизъм.
Варфарин: Множеството дневни дози ситаглиптин не променят значимо фармакокинетиката, както се оценява чрез измерване на S (-) или R (+) варфаринови енантиомери, или фармакодинамика (изчислена чрез измерване на протромбиновата INR) на единична доза варфарин. Тъй като S (-) варфарин се метаболизира предимно от CYP2C9, тези данни също подкрепят заключението, че ситаглиптин не е CYP2C9 инхибитор.
Перорални контрацептиви: Едновременното приложение със ситаглиптин не променя значимо фармакокинетиката на стабилното състояние на норетиндрон или етинил естрадиол.
Ефект на други лекарства върху Sitagliptin
Клиничните данни, описани по-долу, сочат, че ситаглиптинът не е податлив на клинично значими взаимодействия чрез едновременно приемане на лекарства.
Циклоспорин: Проведено е проучване за оценка на ефекта на циклоспорин, мощен инхибитор на р-гликопротеин, върху фармакокинетиката на ситаглиптин. Едновременното приложение на една 100 mg перорална доза ситаглиптин и еднократна перорална доза от 600 mg циклоспорин повишава AUC и Cмакс на ситаглиптин съответно с приблизително 29% и 68%. Тези скромни промени във фармакокинетиката на ситаглиптин не се считат за клинично значими. Бъбречният клирънс на ситаглиптин също не се променя значимо. Следователно не биха се очаквали значими взаимодействия с други инхибитори на p-гликопротеин.
Метформин хидрохлорид
[Виж Взаимодействия с лекарства]
Горна част
Неклинична токсикология
Канцерогенеза, мутагенеза, увреждане на плодовитостта
Janumet
Не са провеждани проучвания върху животни с комбинираните продукти в Janumet за оценка на канцерогенезата, мутагенезата или увреждането на плодовитостта. Следващите данни се основават на резултатите от проучвания със ситаглиптин и метформин поотделно.
Ситаглипитн
Проведено е двугодишно проучване за канцерогенност при мъжки и женски плъхове, даващи перорални дози ситаглиптин от 50, 150 и 500 mg / kg / ден. Има повишена честота на комбиниран чернодробен аденом / карцином при мъже и жени и на чернодробен карцином при жени при 500 mg / kg. Тази доза води до експозиция приблизително 60 пъти по-голяма от експозицията при хора при максимална препоръчителна дневна доза за възрастни хора (MRHD) от 100 mg / ден въз основа на AUC сравнения. Чернодробните тумори не са наблюдавани при 150 mg / kg, приблизително 20 пъти по-голяма от експозицията при хора при MRHD. Проведено е двугодишно проучване за канцерогенност при мъжки и женски мишки, на които са дадени орални дози ситаглиптин от 50, 125, 250 и 500 mg / kg / ден. Няма увеличение на честотата на тумори в който и да е орган до 500 mg / kg, приблизително 70 пъти излагане на хора при MRHD. Ситаглиптин не е мутагенен или кластогенен със или без метаболитно активиране в анализа на мутагенността на Ames, яйчник на китайски хамстер (CHO) тест за хромозомна аберация, анализ за цитогенетика in vitro в СНО, анализ за алкална елуиране на in vitro плъх на ДНК и in vivo микронуклеус анализ.
При проучвания за фертилитета на плъхове с перорални дози от 125, 250 и 1000 mg / kg, мъжете са третирани 4 седмици преди чифтосването, по време на чифтосване, до планирано прекратяване (общо около 8 седмици), а женските се лекуват 2 седмици преди чифтосването през бременността ден 7. Не се наблюдава неблагоприятен ефект върху плодовитостта при 125 mg / kg (приблизително 12 пъти експозиция при хора при MRHD от 100 mg / ден въз основа на AUC сравнения). При по-високи дози се наблюдава увеличена резорбция, свързана с недоза при жени (приблизително 25 и 100 пъти излагане на хора при MRHD въз основа на AUC сравнение).
Метформин хидрохлорид
Проведени са дългосрочни проучвания за канцерогенност при плъхове (продължителност на дозировката 104 седмици) и мишки (продължителност на дозата 91 седмици) при дози до и включително 900 mg / kg / ден и 1500 mg / kg / ден, съответно. Тези дози са и двете приблизително четири пъти максималната препоръчителна дневна доза за човек от 2000 mg въз основа на сравненията на телесната повърхност. Не са открити данни за канцерогенност с метформин нито при мъжки, нито при женски мишки. По подобен начин не е наблюдаван туморогенен потенциал с метформин при мъжки плъхове. Има обаче повишена честота на доброкачествени стромални маточни полипи при женски плъхове, лекувани с 900 mg / kg / ден.
Няма данни за мутагенен потенциал на метформин при следните ин витро тестове: Еймсов тест (S. тифимуриум), тест за генна мутация (клетки на лимфом на мишка) или тест за хромозомни аберации (човешки лимфоцити). Резултатите от in vivo тест за микронуклеус на мишка също бяха отрицателни. Фертилитетът на мъжки или женски плъхове не се повлиява от метформин, когато се прилага в дози до 600 mg / kg / ден, което е приблизително три пъти максималната препоръчителна дневна доза за човека въз основа на телесната повърхност сравнения.
Горна част
Клинични изследвания
Едновременното приложение на ситаглиптин и метформин е проучено при пациенти с диабет тип 2, недостатъчно контролирани при диета и физически упражнения и в комбинация с глимепирид.
Не са провеждани клинични проучвания за ефикасност, проведени с Janumet; въпреки това е доказана биоеквивалентност на Janumet с едновременно прилагани таблетки ситаглиптин и метформин хидрохлорид.
Съвместно приложение на ситаглиптин и метформин при пациенти с диабет тип 2, неадекватно контролирани при диета и упражнения
Общо 1091 пациенти с диабет тип 2 и недостатъчен гликемичен контрол върху диетата и упражненията участваха в 24-седмична, рандомизирано, двойно сляпо, плацебо контролирано факторно проучване, предназначено да оцени ефикасността на ситаглиптин и метформин едновременното приложение. Пациентите на антихипергликемичен агент (N = 541) са подложени на диета, физически упражнения и период на измиване на лекарството до 12 седмици. След периода на измиване пациентите с недостатъчен гликемичен контрол (A1C 7,5% до 11%) са рандомизирани след завършване на 2-седмичен период на еднократно слепене на плацебо. Пациенти, които не са на антихипергликемични средства при влизане в изследването (N = 550) с недостатъчен гликемичен контрол (A1C 7,5% до 11%) веднага влязоха в двуседмичния период на еднократно сляпо плацебо и след това бяха рандомизирано. Приблизително равен брой пациенти бяха рандомизирани да получават плацебо, 100 mg ситаглиптин веднъж дневно, 500 mg или 1000 mg метформин два пъти дневно или 50 mg ситаглиптин два пъти дневно в комбинация с 500 mg или 1000 mg метформин два пъти дневно. Пациентите, които не са успели да постигнат специфични гликемични цели по време на изследването, са били лекувани с глибурид (глибенкламид).
Едновременното приложение на ситаглиптин и метформин осигури значително подобрение на А1С, FPG и двучасов PPG в сравнение с плацебо, само на метформин и само на ситаглиптин (Таблица 3, Фигура 1). Средното намаление от изходната стойност при А1С като цяло е по-голямо при пациенти с по-високи стойности на А1С. При пациенти, които не са на антихипергликемичен агент при започване на проучване, средните намаления от изходната стойност в А1С са: 100 mg ситаглиптин веднъж дневно, -1,1%; метформин 500 mg оферта, -1,1%; метформин 1000 mg оферта, -1,2%; оферта за 50 mg ситаглиптин с 500 mg метформин, -1,6%; ситаглиптин 50 mg оферта с метформин 1000 mg оферта, -1,9%; и за пациенти, получаващи плацебо, -0,2%. Обикновено липидните ефекти са неутрални. Намалението на телесното тегло в групите, даващи ситаглиптин в комбинация с метформин, е подобно на това в групите, даващи само метформин или плацебо.
Таблица 3: Гликемични параметри при последно посещение (24-седмично проучване) за ситаглиптин и метформин, самостоятелно и в комбинация при пациенти с диабет тип 2, които не са достатъчно контролирани при диета и упражнения *
Плацебо |
Ситаглипитн 100 mg QD |
Метформин 500 mg оферта |
Метформин 1000 mg оферта |
Ситаглипитн 50 mg оферта + Метформин 500 mg оферта |
Ситаглипитн 50 mg оферта + Метформин 1000 mg оферта |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Базова линия (средно) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Промяна от основната линия (коригирана средна стойност†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Разлика от плацебо (коригирана средна стойност†) (95% CI) |
-0.8° С (-1.1, -0.6) |
-1.0° С (-1.2, -0.8) |
-1.3° С (-1.5, -1.1) |
-1.6° С (-1.8, -1.3) |
-2.1° С (-2.3, -1.8) |
|
| Пациенти (%), постигащи A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Пациенти, получаващи спасителни лекарства | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Базова линия (средно) | 196 | 201 | 205 | 197 | 204 | 197 |
| Промяна от основната линия (коригирана средна стойност†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Разлика от плацебо (коригирана средна стойност†) (95% CI) |
-23° С (-33, -14) |
-33° С (-43, -24) |
-35° С (-45, -26) |
-53° С (-62, -43) |
-70° С (-79, -60) |
|
| 2 часа PPG (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Базова линия (средно) | 277 | 285 | 293 | 283 | 292 | 287 |
| Промяна от основната линия (коригирана средна стойност†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Разлика от плацебо (коригирана средна стойност†) (95% CI) |
-52° С (-67, -37) |
-54° С (-69, -39) |
-78° С (-93, -63) |
-93° С (-107, -78) |
-117° С (-131, -102) |
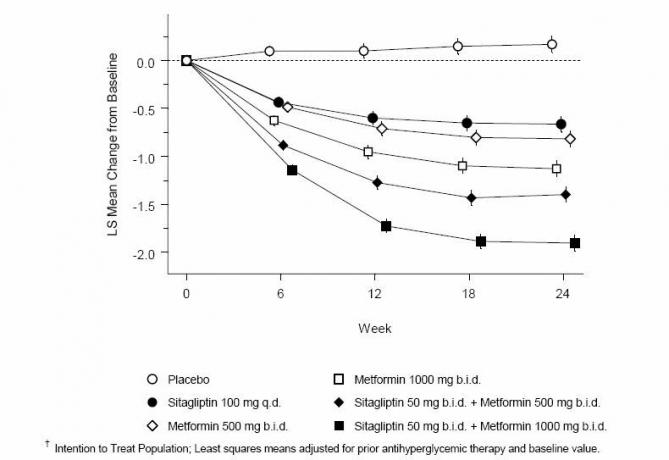
Фигура 1: Средна промяна от базовата линия за A1C (%) за 24 седмици със Sitagliptin и Metformin, Alone и в комбинация при пациенти с диабет тип 2, недостатъчно контролирани с диета и упражнения
В допълнение, това проучване включва пациенти (N = 117) с по-тежка хипергликемия (A1C> 11% или кръв глюкоза> 280 mg / dL), които са били лекувани с два пъти дневно отворени етикети ситаглиптин 50 mg и метформин 1000 мг. При тази група пациенти средната изходна стойност на А1С е 11,2%, средната FPG е 314 mg / dL, а средната двучасова PPG е 441 mg / dL. След 24 седмици се наблюдават средни понижения от изходната стойност от -2,9% за A1C, -127 mg / dL за FPG и -208 mg / dL за 2-часов PPG.
Първоначалната комбинирана терапия или поддържането на комбинирана терапия трябва да бъде индивидуализирана и да се остави на преценката на лекуващия лекар.
Ситаглиптин добавка терапия при пациенти с диабет тип 2, неадекватно контролирани върху метформин самостоятелно
Общо 701 пациенти с диабет тип 2 са участвали в 24-седмично, рандомизирано, двойно-сляпо, плацебо-контролирано проучване, предназначено да оцени ефикасността на ситаглиптин в комбинация с метформин. Пациентите, които вече са на метформин (N = 431) в доза от най-малко 1500 mg на ден, бяха рандомизирани след завършване на 2-седмичен период на еднократно слепене на плацебо. Пациенти с метформин и друг антихипергликемичен агент (N = 229) и пациенти, които не приемат антихипергликемични средства (извън терапия за най-малко 8 седмици, N = 41) бяха рандомизирани след период на изтичане от приблизително 10 седмици на метформин (в доза най-малко 1500 mg на ден) в монотерапия. Пациентите бяха рандомизирани на добавяне на 100 mg ситаглиптин или плацебо, прилагани веднъж дневно. Пациентите, които не са успели да постигнат специфични гликемични цели по време на проучванията, са били лекувани с пиоглитазон.
В комбинация с метформин ситаглиптинът осигури значително подобрение на А1С, FPG и двучасов PPG в сравнение с плацебо с метформин (Таблица 4). Спасителната гликемична терапия е използвана при 5% от пациентите, лекувани със 100 mg ситаглиптин и 14% от пациентите, лекувани с плацебо. Подобно намаление на телесното тегло се наблюдава и за двете терапевтични групи.
Таблица 4: Гликемични параметри при последно посещение (24-седмично проучване) на Sitagliptin в добавъчна комбинирана терапия с метформин *
| Sitagliptin 100 mg QD + Метформин |
Плацебо + Метформин |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Базова линия (средно) | 8.0 | 8.0 |
| Промяна от основната линия (коригирана средна стойност†) | -0.7 | -0.0 |
| Разлика от плацебо + метформин (коригирана средна стойност†) (95% CI) |
-0.7° С (-0.8, -0.5) |
|
| Пациенти (%), постигащи A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Базова линия (средно) | 170 | 174 |
| Промяна от основната линия (коригирана средна стойност†) | -17 | 9 |
| Разлика от плацебо + метформин (коригирана средна стойност†) (95% CI) |
-25° С (-31, -20) |
|
| 2 часа PPG (mg / dL) | N = 387 | N = 182 |
| Базова линия (средно) | 275 | 272 |
| Промяна от основната линия (коригирана средна стойност†) | -62 | -11 |
| Разлика от плацебо + метформин (коригирана средна стойност†) (95% CI) |
-51° С (-61, -41) |
Ситаглиптин за допълнителна терапия при пациенти с диабет тип 2, които не са достатъчно контролирани при комбинацията на метформин и глимепирид
Общо 441 пациенти с диабет тип 2 са участвали в 24-седмична, рандомизирана, двойно-сляпа, плацебо-контролирано проучване, предназначено да оцени ефикасността на ситаглиптин в комбинация с глимепирид, с или без метформин. Пациентите са въвели период на лечение с глимепирид (‰ ¥ 4 mg на ден) самостоятелно или глимепирид в комбинация с метформин (‰ mg 1500 mg на ден). След титриране на дозата и устойчив на дозата период на изтичане до 16 седмици и 2-седмичен период на плацебо, пациент с неадекватен гликемичен контрол (А1С 7,5% до 10,5%) са рандомизирани до добавяне на 100 mg ситаглиптин или плацебо, приложени веднъж дневно. Пациентите, които не са успели да постигнат специфични гликемични цели по време на проучванията, са били лекувани с пиоглитазон.
Пациентите, приемащи ситаглиптин с метформин и глимепирид, имат значителни подобрения в А1С и FPG в сравнение с пациентите, получаващи плацебо с метформин и глимепирид (Таблица 5), със средни намаления от изходната стойност спрямо плацебо в A1C от -0,9% и в FPG от -21 мг / дл. Спасителната терапия се използва при 8% от пациентите, лекувани със 100 mg ситаглиптин, и 29% от пациентите, лекувани с добавка плацебо. Пациентите, лекувани с добавка ситаглиптин, имат средно увеличение на телесното тегло от 1,1 кг спрямо добавка плацебо (+0,4 кг срещу -0,7 кг). В допълнение, ситаглиптинът с добавка доведе до повишен процент на хипогликемия в сравнение с добавеното плацебо. [Виж Предупреждения и предпазни мерки; Нежелани реакции.]
Таблица 5: Гликемични параметри при последно посещение (24-седмично проучване) за ситаглиптин в комбинация с метформин и глимепирид *
| Ситаглиптин 100 mg + Метформин и глимепирид |
Плацебо + Метформин и глимепирид |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Базова линия (средно) | 8.3 | 8.3 |
| Промяна от основната линия (коригирана средна стойност†) | -0.6 | 0.3 |
| Разлика от плацебо (коригирана средна стойност†) (95% CI) | -0.9° С (-1.1, -0.7) |
|
| Пациенти (%), постигащи A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Базова линия (средно) | 179 | 179 |
| Промяна от основната линия (коригирана средна стойност†) | -8 | 13 |
| Разлика от плацебо (коригирана средна стойност†) (95% CI) | -21° С (-32, -10) |
Ситаглиптин добавка терапия vs. Терапия с добавка на глипизид при пациенти с диабет тип 2, при недостатъчно контролиран прием на метформин
Ефективността на ситаглиптин се оценява в 52-седмично двойно-сляпо проучване за нелиферност на контролирана с глипизид при пациенти с диабет тип 2. Пациентите, които не са на лечение или на други антихипергликемични средства, са въвели период на лечение с продължителност до 12 седмици с монотерапия с метформин (доза ‰ mg 1500 mg на ден), която включва отмиване на лекарства, различни от метформин, ако приложимо. След периода на изтичане, тези с недостатъчен гликемичен контрол (А1С 6,5% до 10%) бяха рандомизирани 1: 1 към добавянето на 100 mg ситаглиптин веднъж дневно или глипизид в продължение на 52 седмици. Пациентите, получаващи глипизид, получават първоначална доза от 5 mg / ден и след това избирателно се титруват през следващите 18 седмици до максимална доза от 20 mg / ден, колкото е необходимо за оптимизиране на гликемичния контрол. След това дозата на глипизид трябва да се поддържа постоянна, с изключение на понижаващото титриране, за да се предотврати хипогликемия. Средната доза глипизид след периода на титруване е 10 mg.
След 52 седмици ситаглиптин и глипизид имат сходни средни намаления от изходната стойност в А1С в анализа за намерение за лечение (Таблица 6). Тези резултати са в съответствие с анализа на протокола (Фигура 2). Заключение в полза на не-по-ниската степен на ситаглиптин спрямо глипизид може да бъде ограничено до пациенти с изходно ниво A1C съпоставим с тези, включени в изследването (над 70% от пациентите са имали начална стойност на A1C <8%, а над 90% са имали A1C <9%).
Таблица 6: Гликемични параметри в 52-седмично проучване, сравняващо Sitagliptin с Glipizide като допълнителна терапия при пациенти с недостатъчно контролиран прием на метформин (Намерено за лечение на население) *
| Ситаглиптин 100 mg + Метформин |
глипизид + Метформин |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Базова линия (средно) | 7.7 | 7.6 |
| Промяна от основната линия (коригирана средна стойност†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Базова линия (средно) | 166 | 164 |
| Промяна от основната линия (коригирана средна стойност†) | -8 | -8 |
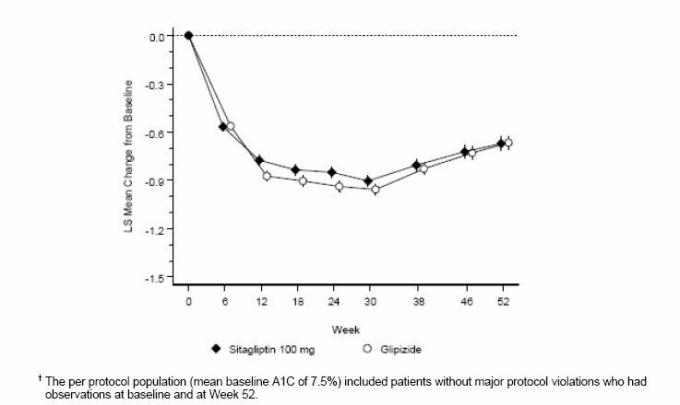
Фигура 2: Средна промяна от базовата линия за A1C (%) над 52 седмици в проучване, сравняващо Sitagliptin с Глипизид като допълнителна терапия при пациенти с недостатъчен контрол върху метформин (по протокол от населението) â€
Честотата на хипогликемия в групата на ситаглиптин (4.9%) е значително (р <0.001) по-ниска от тази в групата на глипизид (32.0%). Пациентите, лекувани със ситаглиптин, показват значително средно понижение от изходната стойност на телесното тегло в сравнение със значително увеличение на теглото при пациенти, прилагани глипизид (-1,5 kg спрямо +1,1 кг).
Горна част
Как се доставя
№ 6747 - Таблетки Janumet, 50 mg / 500 mg, са светло розови, капсуловани, филмирани таблетки с "575", вдлъбнати от едната страна. Те се доставят както следва:
NDC 0006-0575-61 бутилки за 60 единици за употреба
NDC 0006-0575-62 бутилки за 180 единици за употреба
NDC 0006-0575-52 единични дози блистерни опаковки от 50
NDC 0006-0575-82 насипни бутилки от 1000.
№ 6749 - Таблетки Janumet, 50 mg / 1000 mg, са червени таблетки с форма на капсула, филмирани таблетки с надпис „577“ от едната страна. Те се доставят както следва:
NDC 0006-0577-61 бутилки за 60 единици за употреба
NDC 0006-0577-62 бутилки за 180 единици за употреба
NDC 0006-0577-52 единични дози блистерни опаковки от 50
NDC 0006-0577-82 насипни бутилки от 1000.
Да се съхранява при 20-25 ° C (68-77 ° F), разрешени екскурзии до 15-30 ° C (59-86 ° F).
Горна част
Информация за консултации на пациентите
инструкции
Пациентите трябва да бъдат информирани за потенциалните рискове и ползи от Janumet и за алтернативните методи на лечение. Те също трябва да бъдат информирани за значението на спазването на диетичните инструкции, редовното физическо натоварване, периодичната кръв глюкозен мониторинг и A1C тестване, разпознаване и управление на хипогликемия и хипергликемия и оценка за диабет усложнения. По време на стресови периоди като треска, травма, инфекция или хирургическа намеса, нуждите от лекарства могат да се променят и пациентите трябва да бъдат съветвани незабавно да потърсят медицинска помощ.
Рисковете от лактатна ацидоза поради компонента на метформин, неговите симптоми и състояния, предразполагащи към неговото развитие, както е отбелязано в Предупреждения и предпазни мерки, трябва да се обясни на пациентите. Пациентите трябва да бъдат посъветвани незабавно да прекратят Janumet и незабавно да уведомят своя здравен лекар, ако необяснима хипервентилация, миалгия и др. неразположение, необичайна сънливост, замаяност, бавен или нередовен сърдечен ритъм, усещане за усещане за студ (особено в крайниците) или други неспецифични симптоми възникне. Стомашно-чревните симптоми са чести по време на започване на лечение с метформин и могат да се появят по време на започване на терапията с Janumet; въпреки това пациентите трябва да се консултират със своя лекар, ако развият необясними симптоми. Въпреки че стомашно-чревните симптоми, които се появяват след стабилизиране, е малко вероятно да са свързани с лекарства, такова появата на симптоми трябва да бъде оценена, за да се определи дали това може да се дължи на лактатна ацидоза или друга сериозна заболяване.
Пациентите трябва да бъдат съветвани срещу прекомерния прием на алкохол, или остър, или хроничен, докато получават Janumet.
Пациентите трябва да бъдат информирани за важността на редовното тестване на бъбречната функция и хематологичните параметри при получаване на лечение с Janumet.
Пациентите трябва да бъдат информирани, че са съобщени алергични реакции по време на постмаркетинговата употреба на ситаглиптин, един от компонентите на Janumet. Ако симптоми на алергични реакции (включително обрив, копривна треска и подуване на лицето, устните, езика и гърлото, това може да стане възникнат затруднено дишане или преглъщане), пациентите трябва да спрат да приемат Janumet и да потърсят лекарска помощ незабавно.
Лекарите трябва да инструктират пациентите си да прочетат вложката за пациентен пакет преди започване на терапията с Janumet и да ги препрочитат всеки път, когато рецептата се подновява. Пациентите трябва да бъдат инструктирани да информират своя лекар или фармацевт, ако развият някакъв необичаен симптом или ако някой известен симптом продължава или се влошава.
Лабораторни тестове
Реакцията на всички диабетични терапии трябва да се следи чрез периодични измервания на кръвната захар и нивата на А1С, с цел тези нива да бъдат намалени до нормалните граници. А1С е особено полезен за оценка на дългосрочен гликемичен контрол.
Първоначално и периодично проследяване на хематологичните параметри (напр. Хемоглобин / хематокрит и червена кръв клетъчни индекси) и бъбречната функция (серумен креатинин) трябва да се извършват, поне на годишна база. Докато рядко е наблюдавана мегалобластна анемия при терапия с метформин, ако се подозира това, дефицитът на витамин В12 трябва да бъде изключен.
Разпространено от:
MERCK & CO., INC., Whitehouse Station, NJ 08889, САЩ
9794108
Патент на САЩ: 6,699,871
1 Регистрирана търговска марка на MERCK & CO., Inc., Whitehouse Station, Ню Джърси 08889 САЩ
2Tememark на MERCK & CO., Inc., гара Уайтхаус, Ню Джърси 08889 САЩ
3GLUCOPHAGE® е регистрирана търговска марка на Merck Sante S.A.S, сътрудник на Merck KGaA от Дармщат, Германия.
Лицензиран за Bristol-Myers Squibb Company.
АВТОРСКО ПРАВО © 2007, 2008 MERCK & CO., Inc.
Всички права запазени
Одобрено от FDA етикетиране на пациента
Информация за пациента
Janumet® (JAN-you-met)
(ситаглиптин / метформин НС1)
Таблети
Прочетете информацията за пациента, която се доставя с Janumet1, преди да започнете да го приемате и всеки път, когато получите пълнене. Възможно е да има нова информация. Тази листовка не заема мястото на разговор с вашия лекар за вашето медицинско състояние или лечение.
Коя е най-важната информация, която трябва да знам за Janumet?
Метформин хидрохлорид, една от съставките в Janumet, може да причини рядък, но сериозен страничен ефект, наречен лактатна ацидоза (натрупване на млечна киселина в кръвта), който може да причини смърт. Млечната ацидоза е спешна медицинска помощ и трябва да се лекува в болница.
Спрете приема на Janumet и се обадете веднага на вашия лекар, ако получите някой от следните симптоми на лактатна ацидоза:
- Чувствате се много слаба и уморена.
- Имате необичайна (не нормална) болка в мускулите.
- Имате проблеми с дишането.
- Имате необясними стомашни или чревни проблеми с гадене и повръщане или диария.
- Усещате студ, особено в ръцете и краката.
- Чувствате се виене на свят или светоглед.
- Имате бавен или нередовен сърдечен ритъм.
Имате по-голям шанс да получите лактатна ацидоза, ако:
- имат проблеми с бъбреците.
- имат проблеми с черния дроб.
- имат застойна сърдечна недостатъчност, която изисква лечение с лекарства.
- пийте много алкохол (много често или краткотрайно пиене "питие").
- дехидратирайте (загубите голямо количество телесни течности). Това може да се случи, ако сте болни с треска, повръщане или диария. Дехидратацията може да се случи и когато се потите много с активност или упражнения и не пиете достатъчно течности.
- имат определени рентгенови тестове с инжекционни оцветители или контрастни вещества.
- направи операция.
- имате сърдечен удар, тежка инфекция или инсулт.
- са на 80 години или повече и не са тествали бъбречната ви функция.
Какво е Janumet?
Таблетките Janumet съдържат две лекарства, отпускани по лекарско предписание, ситаглиптин (JANUVIA ™ 2) и метформин. Janumet може да се използва заедно с диета и упражнения за понижаване на кръвната захар при възрастни пациенти с диабет тип 2. Вашият лекар ще определи дали Janumet е подходящ за вас и ще определи най-добрия начин да започнете и продължите да лекувате диабета си.
Janumet:
- помага за подобряване нивата на инсулин след хранене.
- помага на тялото да реагира по-добре на инсулина, който прави естествено.
- намалява количеството захар, направено от организма.
- е малко вероятно да причини ниска кръвна захар (хипогликемия), когато се приема за лечение на висока кръвна захар.
Janumet не е проучван при деца под 18 години.
Janumet не е изследван с инсулин, лекарство, за което се знае, че причинява ниска кръвна захар.
Кой не трябва да приема Янумет?
Не приемайте Janumet, ако:
- имате диабет тип 1.
- имат определени проблеми с бъбреците.
- имат състояния, наречени метаболитна ацидоза или диабетна кетоацидоза (повишени кетони в кръвта или урината).
- са имали алергична реакция към Janumet или ситаглиптин (JANUVIA), един от компонентите на Janumet.
- ще получат инжекция от багрило или контрастни средства за рентгенова процедура, Janumet ще трябва да бъде спрян за кратко време. Говорете с Вашия лекар кога да спрете Janumet и кога да започнете отново. Вижте "Коя е най-важната информация, която трябва да знам за Janumet?"
Какво трябва да кажа на моя лекар преди и по време на лечението с Janumet?
Janumet може да не е подходящ за вас. Кажете на Вашия лекар за всичките си медицински състояния, включително ако:
- имат проблеми с бъбреците.
- имат проблеми с черния дроб.
- са имали алергична реакция към Janumet или ситаглиптин (JANUVIA), един от компонентите на Janumet.
- имат сърдечни проблеми, включително застойна сърдечна недостатъчност.
- са по-стари от 80 години. Пациенти над 80 години не трябва да приемат Janumet, освен ако бъбречната им функция е проверена и това е нормално.
- пийте много алкохол (през цялото време или краткосрочно пиене на "гуляй").
- сте бременна или планирате да забременеете. Не е известно дали Janumet ще навреди на вашето неродено бебе. Ако сте бременна, говорете с вашия лекар за най-добрия начин да контролирате кръвната захар, докато сте бременна. Ако използвате Janumet по време на бременност, говорете с вашия лекар за това как можете да бъдете в регистъра на Janumet. Безплатният телефонен номер за регистъра на бременността е 1-800-986-8999.
- кърмите или планирате да кърмите. Не е известно дали Janumet ще премине в кърмата ви. Говорете с вашия лекар за най-добрия начин за хранене на вашето бебе, ако приемате Janumet.
Информирайте Вашия лекар за всички лекарства, които приемате, включително лекарства без рецепта и без рецепта, витамини и билкови добавки. Janumet може да повлияе на това колко добре действат други лекарства, а някои лекарства могат да повлияят на това колко добре работи Janumet.
Знайте лекарствата, които приемате. Съхранявайте списък с вашите лекарства и го показвайте на вашия лекар и фармацевт, когато получите ново лекарство. Говорете с Вашия лекар, преди да започнете ново лекарство.
Как трябва да приемам Janumet?
- Вашият лекар ще Ви каже колко таблетки Janumet да приемете и колко често трябва да ги приемате. Приемайте Janumet точно както Ви е казал Вашият лекар.
- Вашият лекар може да се наложи да увеличите дозата си, за да контролира кръвната захар.
- Вашият лекар може да Ви предпише Janumet заедно със сулфонилурея (друго лекарство за понижаване на кръвната захар). Вижте "Какви са възможните нежелани реакции на Janumet?" за информация за повишен риск от ниска кръвна захар.
- Приемайте Янумет с храна, за да намалите шанса за разстроен стомах.
- Продължете да приемате Janumet, докато вашият лекар Ви каже.
- Ако приемете твърде много Janumet, незабавно се обадете на Вашия лекар или център за контрол на отровата.
- Ако сте пропуснали доза, приемайте я с храна веднага щом се сетите. Ако не си спомняте, докато не дойде време за следващата ви доза, пропуснете пропуснатата доза и се върнете към обичайния си график. Не приемайте две дози Янумет едновременно.
- Може да се наложи да спрете приема на Янумет за кратко. Обадете се на вашия лекар за инструкции, ако:
- са дехидратирани (загубили са твърде много телесна течност). Дехидратацията може да възникне, ако сте болни с тежко повръщане, диария или треска или ако пиете много по-малко течност от нормалното.
- планирате операция.
- ще получите инжекция от багрило или контрастно средство за рентгенова процедура.
Вижте "Коя е най-важната информация, която трябва да знам за Janumet?" и "Кой не трябва да приема Янумет?"
- Когато тялото ви е подложено на някои видове стрес, като треска, травма (като автомобилна катастрофа), инфекция или операция, количеството на лекарството за диабет, от което се нуждаете, може да се промени. Кажете на Вашия лекар веднага, ако имате някое от тези състояния и следвайте инструкциите на Вашия лекар.
- Проследявайте кръвната захар, както Ви е казал Вашият лекар.
- Спазвайте предписаната от вас диета и тренировъчна програма, докато приемате Janumet.
- Говорете с Вашия лекар как да предотвратите, разпознаете и управлявате ниската кръвна захар (хипогликемия), високата кръвна захар (хипергликемия) и усложненията на диабета.
- Вашият лекар ще наблюдава вашия диабет с редовни кръвни изследвания, включително нивата на кръвната ви захар и вашия хемоглобин А1С.
- Вашият лекар ще направи кръвни изследвания, за да провери работата на бъбреците ви преди и по време на лечението с Janumet.
Какви са възможните странични ефекти от Janumet?
Janumet може да причини сериозни странични ефекти. Вижте "Коя е най-важната информация, която трябва да знам за Janumet?"
Честите нежелани реакции при прием на Janumet включват:
- запушен или хрема и болки в гърлото
- инфекция на горните дихателни пътища
- диария
- гадене и повръщане
- газове, стомашен дискомфорт, лошо храносмилане
- слабост
- главоболие
Приемът на Janumet с храна може да помогне за намаляване на общите странични ефекти на метформин в стомаха, които обикновено се появяват в началото на лечението. Ако имате необичайни или неочаквани стомашни проблеми, консултирайте се с Вашия лекар. Проблемите със стомаха, които започват по-късно по време на лечението, може да са знак за нещо по-сериозно.
Някои лекарства за диабет, като сулфонилуреи и меглитиниди, могат да причинят ниска кръвна захар (хипогликемия). Когато Janumet се използва с тези лекарства, може да имате кръвни захари, които са твърде ниски. Вашият лекар може да Ви предпише по-ниски дози от сулфонилуреята или меглитинидовото лекарство. Уведомете Вашия лекар, ако имате проблеми с ниската кръвна захар.
Следните допълнителни нежелани реакции са съобщени при обща употреба с Janumet или ситаглиптин:
- Сериозни алергични реакции могат да се случат с Janumet или ситаглиптин, едно от лекарствата в Janumet. Симптомите на сериозна алергична реакция могат да включват обрив, копривна треска и подуване на лицето, устните, езика и гърлото, затруднено дишане или преглъщане. Ако имате алергична реакция, спрете приема на Janumet и се обадете веднага на вашия лекар. Вашият лекар може да Ви предпише лекарство за лечение на Вашата алергична реакция и различно лекарство за Вашия диабет.
- Повишени чернодробни ензими.
- Възпаление на панкреаса.
Това не са всички възможни странични ефекти на Janumet. За повече информация попитайте Вашия лекар.
Кажете на Вашия лекар, ако имате някакъв страничен ефект, който Ви притеснява, е необичаен или не отшумява.
Как трябва да съхранявам Janumet?
Съхранявайте Janumet при стайна температура, 68-25 ° F (20-25 ° C).
Пазете Janumet и всички лекарства на място, недостъпно за деца.
Обща информация за употребата на Janumet
Лекарствата понякога се предписват при състояния, които не са упоменати в листовките с информация за пациента. Не използвайте Janumet при състояние, за което не е предписано. Не давайте Янумет на други хора, дори ако те имат същите симптоми като вас. Може да им навреди.
Тази листовка обобщава най-важната информация за Janumet. Ако искате да знаете повече информация, консултирайте се с Вашия лекар. Можете да попитате вашия лекар или фармацевт за информация за Janumet, която е написана за здравни специалисти. За повече информация се обадете на 1-800-622-4477.
Какви са съставките в Janumet?
Активни съставки: ситаглиптин и метформин хидрохлорид.
Неактивни съставки: микрокристална целулоза, поливинилпиролидон, натриев лаурил сулфат и натриев стеарил фумарат. Покритието на таблетния филм съдържа следните неактивни съставки: поливинилов алкохол, полиетилен гликол, талк, титанов диоксид, червен железен оксид и черен железен оксид.
Какво е диабет тип 2?
Диабет тип 2 е състояние, при което тялото ви не прави достатъчно инсулин, а инсулинът, който тялото ви произвежда, не работи толкова добре, колкото би трябвало. Тялото ви също може да направи прекалено много захар. Когато това се случи, захарта (глюкозата) се натрупва в кръвта. Това може да доведе до сериозни медицински проблеми.
Основната цел на лечението на диабет е да свалите кръвната си захар до нормално ниво. Понижаването и контролирането на кръвната захар може да помогне за предотвратяване или забавяне на усложненията на диабета, като сърдечни проблеми, проблеми с бъбреците, слепота и ампутация.
Високата кръвна захар може да бъде понижена чрез диета и упражнения, както и от определени лекарства, когато е необходимо.
Издаден март 2009 г.
Разпространено от:
MERCK & CO., INC., Whitehouse Station, NJ 08889, САЩ
Последна актуализация: 03/09
Janumet, Sitagliptin и Metformin Hydrochloride, Информация за пациента (на обикновен английски)
Подробна информация за признаците, симптомите, причините, лечението на диабета
Информацията в тази монография не е предназначена да обхване всички възможни употреби, указания, предпазни мерки, лекарствени взаимодействия или нежелани ефекти. Тази информация е обобщена и не е предназначена за конкретни медицински съвети. Ако имате въпроси относно лекарствата, които приемате или искате повече информация, консултирайте се с Вашия лекар, фармацевт или медицинска сестра.
обратно към: Прегледайте всички лекарства за диабет



