Глюкофаг за лечение на диабет
Марка: Glucophage
Общо наименование: метформин хидрохлорид
Лекарствена форма: таблетки с удължено освобождаване
Съдържание:
описание
Клинична фармакология
Показания и употреба
Противопоказания
Предупреждения
предпазни мерки
Взаимодействия с лекарства
Нежелани реакции
свръх доза
дозиране
Доставя
Глюкогаж, метформин хидрохлорид, информация за пациента (на обикновен английски)
описание
Glucophage® (метформин хидрохлорид) Таблетки и Glucophage® XR (метформин хидрохлорид) Таблетките с удължено освобождаване са перорални антихипергликемични лекарства, използвани при лечението на диабет тип 2. Метформин хидрохлорид (N, N-диметилимидодикарбонимидиев диамид хидрохлорид) не е химически или фармакологично свързан с други класове перорални антихипергликемични средства. Структурната формула е както е показано:
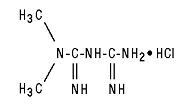
Метформин хидрохлорид е бяло до почти бяло кристално съединение с молекулна формула на C4H11N5 - HCl и молекулно тегло от 165,63. Метформин хидрохлорид е свободно разтворим във вода и е практически неразтворим в ацетон, етер и хлороформ. PKa на метформин е 12.4. PH на 1% воден разтвор на метформин хидрохлорид е 6,68.
Глюкофажните таблетки съдържат 500 mg, 850 mg или 1000 mg метформин хидрохлорид. Всяка таблетка съдържа неактивни съставки повидон и магнезиев стеарат. В допълнение, покритието за таблетки от 500 mg и 850 mg съдържа хипромелоза, а покритието за таблетката от 1000 mg съдържа хипромелоза и полиетилен гликол.
Glucophage XR съдържа 500 mg или 750 mg метформин хидрохлорид като активна съставка.
Glucophage XR 500 mg таблетки съдържат неактивните съставки натриева карбоксиметил целулоза, хипромелоза, микрокристална целулоза и магнезиев стеарат.
Glucophage XR 750 mg таблетки съдържат неактивните съставки натриева карбоксиметил целулоза, хипромелоза и магнезиев стеарат.
Компонентите на системата и Performance-Glucophage XR съдържа двойна хидрофилна полимерна матрична система. Метформин хидрохлорид се комбинира с контролиращ освобождаването на лекарството полимер за образуване на "вътрешна" фаза, която след това се включва като отделни частици във "външна" фаза на втори полимер. След приложение течността от стомашно-чревния (GI) тракт навлиза в таблетката, което кара полимерите да се хидратират и набъбват. Лекарството се освобождава бавно от лекарствената форма чрез процес на дифузия през гел матрицата, която по същество не зависи от рН. Хидратираната полимерна система не е твърда и се очаква да се разруши при нормална перисталтика в GI тракта. Биологично инертните компоненти на таблетката могат понякога да останат непокътнати по време на GI транзит и да бъдат елиминирани в изпражненията като мека, хидратирана маса.
Горна част
Клинична фармакология
Механизъм на действие
Метформин е антихипергликемичен агент, който подобрява глюкозния толеранс при пациенти с диабет тип 2, като понижава базалната и постпрандиалната плазмена глюкоза. Неговите фармакологични механизми на действие са различни от другите класове перорални антихипергликемични средства. Метформинът намалява чернодробната глюкоза, намалява чревната абсорбция на глюкоза и подобрява чувствителността към инсулин чрез увеличаване на периферното усвояване и използване на глюкозата. За разлика от сулфонилуреите, метформинът не предизвиква хипогликемия нито при пациенти с диабет тип 2, нито при нормални пациенти (освен при специални обстоятелства, вж. МЕРКИ) и не предизвиква хиперинсулинемия. При терапията с метформин секрецията на инсулин остава непроменена, докато нивата на инсулин на гладно и целодневната реакция на плазмения инсулин всъщност могат да намалят.
Фармакокинетика
Абсорбция и бионаличност
Абсолютната бионаличност на таблетка Glucophage 500 mg, дадена при гладуване, е приблизително от 50% до 60%. Проучвания, използващи единични перорални дози от 500 до 1500 mg Glucophage и 850 до 2550 mg, показват, че липсва пропорционалност на дозата с увеличаване на дозите, което се дължи на намалена абсорбция, а не промяна в елиминиране. Храната намалява степента и леко забавя абсорбцията на метформин, както се вижда от приблизително 40% по-ниска средна пикова плазма концентрация (Cmax), 25% по-ниска площ под плазмената концентрация спрямо кривата на времето (AUC) и удължаване на времето до 35 минути плазмена концентрация (Tmax) след прилагане на една 850 mg таблетка метформин с храна, в сравнение със същата сила на таблетката прилага гладно. Клиничното значение на тези понижения не е известно.
След еднократна перорална доза Glucophage XR, Cmax се постига със средна стойност от 7 часа и диапазон от 4 до 8 часа. Пиковите плазмени нива са приблизително с 20% по-ниски в сравнение със същата доза Glucophage, но степента на абсорбция (измерена чрез AUC) е подобна на Glucophage.
В стационарно състояние AUC и Cmax са по-малки от пропорционални на дозата за Glucophage XR в диапазона от 500 до 2000 mg, прилаган веднъж дневно. Пиковите плазмени нива са приблизително 0,6, 1,1, 1,4 и 1,8 µg / mL за 500, 1000, 1500 и 2000 mg веднъж дневно. Степента на абсорбция на метформин (измерена чрез AUC) от Glucophage XR при доза от 2000 mg веднъж дневно е подобна на същата обща дневна доза, прилагана като Glucophage таблетки 1000 mg два пъти дневно. След многократно приложение на Glucophage XR, метформинът не се натрупва в плазмата.
Променливостта в субекта в Cmax и AUC на метформин от Glucophage XR е сравнима с тази с Glucophage.
Въпреки че степента на абсорбция на метформин (измерена чрез AUC) от Glucophage XR таблетката увеличава се с приблизително 50%, когато се дава с храна, няма ефект на храната върху Cmax и Tmax на метформин. И двете с високо и ниско съдържание на мазнини имат същия ефект върху фармакокинетиката на Glucophage XR.
разпределение
Привидният обем на разпределение (V / F) на метформин след еднократни перорални дози 850 mg Glucophage е средно 654 ± 358 L. Метформинът е незначително свързан с плазмените протеини, за разлика от сулфонилуреите, които са свързани повече от 90% протеин. Метформиновите дялове в еритроцитите, най-вероятно като функция на времето. При обичайни клинични дози и схеми на дозиране на Glucophage, стационарните плазмени концентрации на метформин се достигат в рамките на 24 до 48 часа и обикновено са
Метаболизъм и елиминиране
Интравенозните проучвания за еднократна доза при нормални индивиди показват, че метформинът се екскретира непроменен при урина и не се подлага на чернодробен метаболизъм (не са установени метаболити при хора), нито жлъчни екскреция. Бъбречен клирънс (виж маса 1) е приблизително 3,5 пъти по-голям от клирънс на креатинин, което показва, че тръбната секреция е основният път на елиминиране на метформин. След перорално приложение приблизително 90% от абсорбираното лекарство се елиминира по бъбречния път в рамките на първите 24 часа, като плазменият полуживот елиминира приблизително 6,2 часа. В кръвта елиминационният полуживот е приблизително 17,6 часа, което предполага, че еритроцитната маса може да бъде отделение за разпределение.
Специални популации
Пациенти с диабет тип 2
При наличие на нормална бъбречна функция няма разлики между еднократна или многодозова фармакокинетика на метформин между пациенти с диабет тип 2 и нормални индивиди (вж. маса 1), нито има натрупване на метформин в двете групи при обичайни клинични дози.
Фармакокинетиката на Glucophage XR при пациенти с диабет тип 2 е сравнима с тази при здрави нормални възрастни.
Бъбречна недостатъчност
При пациенти с намалена бъбречна функция (въз основа на измерен клирънс на креатинин), плазмения и кръвния полуживот на метформинът се удължава и бъбречният клирънс се намалява пропорционално на намаляването на креатининовия клирънс (вж маса 1; също вижте Предупреждения).
Чернодробна недостатъчност
Не са провеждани фармакокинетични проучвания на метформин при пациенти с чернодробна недостатъчност.
гериатрия
Ограничените данни от контролирани фармакокинетични проучвания на Glucophage при здрави пациенти в напреднала възраст показват, че общата плазма клирънсът на метформин е намален, полуживотът се удължава и Cmax се увеличава в сравнение със здрави млади субекти. От тези данни се вижда, че промяната във фармакокинетиката на метформин със стареене се дължи основно на промяна в бъбречната функция (вж. маса 1). Глюкофаг (метформин хидрохлорид) Таблетки и глюкофаг XR (метформин хидрохлорид) Лечението с таблетки с удължено освобождаване не трябва да се започне при пациенти на възраст 80 години, освен ако измерването на креатининовия клирънс не покаже, че бъбречната функция не е намалена (виж Предупреждения и ДОЗИРОВКА И АДМИНИСТРАЦИЯ).
Таблица 1: Изберете средни (± S.D.) Фармакокинетични параметри на метформин след единични или многократни орални дози глюкофаг
| Тематични групи: Глюкофажна дозаа (брой теми) |
° Смаксб (µg / mL) |
Tмакс° С (часа) |
Бъбречно клирънс (Мл / мин) |
|---|---|---|---|
| а Всички дози, дадени на гладно, с изключение на първите 18 дози от проучванията за многократна доза | |||
| б Пикова плазмена концентрация | |||
| ° С Време до пикова плазмена концентрация | |||
| д Комбинирани резултати (средно средно ниво) на пет проучвания: средна възраст 32 години (диапазон 23-59 години) | |||
| д Кинетично проучване, направено след доза 19, на гладно | |||
| е Пациенти в напреднала възраст, средна възраст 71 години (обхват 65-81 години) | |||
| г CLкр = креатининовият клирънс се нормализира до повърхността на тялото 1,73 m2 | |||
| Здрави, недиабетни възрастни: | |||
| 500 mg еднократна доза (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg еднократна доза (74)д | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg три пъти дневно за 19 дозид (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Възрастни с диабет тип 2: | |||
| 850 mg еднократна доза (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg три пъти дневно за 19 дозид (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| Възрастене, здрави недиабетни възрастни: | |||
| 850 mg еднократна доза (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Бъбречно увредени възрастни: | |||
| 850 mg еднократна доза | |||
| Лек (CL)крг 61-90 mL / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Умерен (CL)кр 31-60 mL / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Тежка (CL)кр 10-30 мл / мин) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
педиатрия
След прилагане на единична перорална таблетка Glucophage 500 mg с храна, средният геометричен метформин Cmax и AUC се различават по-малко от 5% между педиатрични пациенти с диабет тип 2 (на възраст 12-16 години) и здрави възрастни (20-45 години), съответстващи на пола и теглото, всички с нормална бъбречна функция функция
пол
Фармакокинетичните параметри на метформин не се различават значително между нормалните индивиди и пациентите с диабет тип 2, когато са анализирани според пол (мъже = 19, жени = 16). По същия начин, при контролирани клинични проучвания при пациенти с диабет тип 2, антихипергликемичният ефект на Glucophage е съпоставим при мъжете и жените.
раса
Не са провеждани проучвания на фармакокинетичните параметри на метформин според расата. В контролирани клинични проучвания на Glucophage при пациенти с диабет тип 2, антихипергликемичният ефект е съпоставим при белите (n = 249), черните (n = 51) и испаноядците (n = 24).
Клинични изследвания
Glucophage
В двойно сляпо, плацебо-контролирано, многоцентрово клинично проучване в САЩ, включващо пациенти със затлъстяване с диабет тип 2, чиято хипергликемия не е била адекватно контролирана с самостоятелно управление на диетата (плазмена глюкоза на гладно на гладно [FPG] от приблизително 240 mg / dL), лечение с глюкофаг (до 2550 mg / ден) в продължение на 29 седмици доведе до значително средно нетно намаление на плазмената глюкоза на гладно и постпрандиална (PPG) и хемоглобина A1c (HbA1c) от 59 mg / dL, 83 mg / dL и 1,8%, в сравнение с плацебо групата (вж. Таблица 2).
Таблица 2: Глюкофаг срещу плацебо Обобщение на средните промени от изходното ниво * в плазмена глюкоза на гладно, HbA1ви телесно тегло при последно посещение (29-седмично проучване)
| Glucophage (П = 141) |
Плацебо (П = 145) |
р-стойност | |
|---|---|---|---|
| * Всички пациенти на диетична терапия на Baseline | ** Не е статистически значима | ||
| FPG (mg / dL) Изходна Промяна при окончателно посещение |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Хемоглобин А1c (%) Изходна Промяна при окончателно посещение |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Тегло на тялото (фунти) Изходна Промяна при окончателно посещение |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
Проведено е 29-седмично, двойно сляпо, плацебо-контролирано проучване на глюкофаг и глибурид, самостоятелно и в комбинация, при пациенти със затлъстяване с тип 2 диабет, който не е успял да постигне адекватен гликемичен контрол, докато е бил на максимални дози глибурид (изходен FPG от приблизително 250 mg / dL) (вж. таблицата 3). Пациентите, рандомизирани на комбинираната рамо, започват терапия с Glucophage 500 mg и глибурид 20 mg. В края на всяка седмица от първите 4 седмици на изпитването, тези пациенти са увеличавали дозите си от глюкофаг с 500 mg, ако не са успели да достигнат целевата плазмена глюкоза на гладно. След 4-та седмица такива корекции на дозата се правят месечно, въпреки че на нито един пациент не е разрешено да надвишава 2500 mg глюкофаг. Пациентите в рамото само на Glucophage (метформин плюс плацебо) следваха същата схема на титруване. В края на проучването приблизително 70% от пациентите в комбинираната група са приемали Glucophage 2000 mg / глибурид 20 mg или Glucophage 2500 mg / глибурид 20 mg. Пациентите, рандомизирани да продължат приема на глибурид, преживяват влошаване на гликемичния контрол, със средно повишаване на FPG, PPG и HbA1c от 14 mg / dL, 3 mg / dL и 0,2%, съответно. За разлика от тях, тези, рандомизирани на Glucophage (до 2500 mg / ден), претърпяха леко подобрение със средно намаление на FPG, PPG и HbA1c от 1 mg / dL, 6 mg / dL и 0,4%, съответно. Комбинацията от глюкофаг и глибурид беше ефективна за намаляване на нивата на FPG, PPG и HbA1c съответно с 63 mg / dL, 65 mg / dL и 1,7%. В сравнение с резултатите от самото лечение с глибурид, нетните разлики при комбинирано лечение са съответно -77 mg / dL, -68 mg / dL и -1.9% (вж. Таблица 3).
Таблица 3: Комбинирана глюкофага / глибурид (гребен) срещу глибурид (глиб) или глюкофаг (GLU) монотерапия: обобщение на средните промени от изходното ниво * в плазмена глюкоза на гладно, HbA1ви телесно тегло при последно посещение (29-седмично проучване)
| р-стойности | ||||||
|---|---|---|---|---|---|---|
| Гребен (П = 213) |
Glyb (П = 209) |
GLU (П = 210) |
Глиб срещу Гребен |
GLU vs Гребен |
GLU vs Glyb |
|
| * Всички пациенти на глибурид, 20 mg / ден, на база | ** Не е статистически значима | |||||
| Плазмена глюкоза на гладно (mg / dL) | ||||||
| Изходна Промяна при окончателно посещение |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Хемоглобин А1c (%) | ||||||
| Изходна Промяна при окончателно посещение |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Тегло на тялото (фунти) | ||||||
| Изходна Промяна при окончателно посещение |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Степента на намаляване на концентрацията на кръвна глюкоза на гладно след институцията на Глюкофаг (метформин хидрохлорид) Терапията с таблетки е пропорционална на нивото на гладуване хипергликемия. Пациентите с диабет тип 2 с по-високи концентрации на глюкоза на гладно изпитват по-голям спад в плазмената глюкоза и гликозилиран хемоглобин.
В клинични проучвания, глюкофагът, самостоятелно или в комбинация със сулфонилурея, понижава средния серум на гладно нива на триглицериди, общ холестерол и LDL холестерол и не са имали неблагоприятни ефекти върху други липидни нива (вж. Таблица 4).
Таблица 4: Обобщение на средното процентно изменение от изходната стойност на основните серумни липидни променливи при окончателно посещение (29-седмични проучвания)
| Глюкофаг срещу Плацебо | Комбиниран глюкофаг / глибурид срещу монотерапия |
||||
|---|---|---|---|---|---|
| Glucophage (П = 141) |
Плацебо (П = 145) |
Glucophage (П = 210) |
Glucophage / глибурид (П = 213) |
глибурид (П = 209) |
|
| Общ холестерол (mg / dL) | |||||
| Изходна Средно% промяна при окончателно посещение |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Общи триглицериди (mg / dL) | |||||
| Изходна Средно% промяна при окончателно посещение |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-холестерол (mg / dL) | |||||
| Изходна Средно% промяна при окончателно посещение |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-холестерол (mg / dL) | |||||
| Изходна Средно% промяна при окончателно посещение |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
За разлика от сулфонилуреите, телесното тегло на индивидите на Глюкофаг има тенденция да остава стабилно или дори да намалее до известна степен (вж. Таблици 2 и 3).
24-седмично, двойно-сляпо, плацебо-контролирано проучване на Glucophage плюс инсулин срещу инсулин плюс плацебо беше проведено при пациенти с диабет тип 2, които не успяха да постигнат адекватен гликемичен контрол само върху инсулина (вж Таблица 5). Пациентите, рандомизирани да получават Glucophage плюс инсулин, постигнаха намаляване на HbA1c от 2.10%, в сравнение с 1.56% намаление на HbA1c, постигнато от инсулин плюс плацебо. Подобрението на гликемичния контрол е постигнато при последното проучване с 16% по-малко инсулин, 93,0 U / ден срещу 110,6 U / ден, Glucophage плюс инсулин срещу инсулин плюс плацебо, съответно, p = 0,04.
Таблица 5: Комбиниран глюкофаг / инсулин срещу плацебо / инсулин Обобщение на средните промени от изходната стойност в HbA1в и дневна доза инсулин
| Glucophage / инсулин (П = 26) |
Плацебо / инсулин (П = 28) |
лечение разлика Средно ± SE |
|
|---|---|---|---|
|
а Статистически значима при използване на анализ на ковариация с базова линия като ковариант (p = 0,04) Не значимо при използване на анализ на дисперсията (стойности, показани в таблицата) | |||
| б Статистически значим за инсулина (р = 0,04) | |||
| Хемоглобин А1c (%) | |||
| Изходна Промяна при окончателно посещение |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43а |
| Доза инсулин (U / ден) | |||
| Изходна Промяна при окончателно посещение |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77б |
Второ двойно-сляпо, плацебо-контролирано проучване (n = 51), с 16 седмици рандомизирано лечение, показа, че при пациенти с диабет тип 2, контролирани на инсулин в продължение на 8 седмици със среден HbA1c от 7.46 ± 0.97%, добавянето на Glucophage поддържа подобен гликемичен контрол (HbA1c 7,15 ± 0,61 срещу 6,97 ± 0,62 за Glucophage плюс инсулин и плацебо плюс инсулин, съответно) с 19% по-малко инсулин спрямо изходната стойност (намаление с 23,68 ± 30,22 спрямо увеличение с 0,43 ± 25,20 единици за Glucophage плюс инсулин и плацебо плюс инсулин, р <0.01). В допълнение, това проучване показа, че комбинацията от Glucophage плюс инсулин води до намаляване телесно тегло от 3,11 ± 4,30 фунта в сравнение с увеличение от 1,30 ± 6,08 паунда за плацебо плюс инсулин, р = 0,01.
Глюкофаг XR
Проведено е 24-седмично двойно сляпо, плацебо-контролирано проучване на Glucophage XR, взето веднъж дневно с вечерното хранене в пациенти с диабет тип 2, които не са успели да постигнат гликемичен контрол с диета и упражнения (HbA1c 7.0% -10.0%, FPG 126-270 мг / дл). Пациентите, влизащи в изследването, имат средна изходна стойност на HbA1c от 8,0% и средна базова стойност на FPG от 176 mg / dL. След 12-седмично лечение средната стойност на HbA1c се е повишила от изходната стойност с 0,1%, а средната FPG е намаляла от изходната стойност с 2 mg / dL в групата на плацебо, в сравнение с намаление на средния HbA1c с 0,6% и понижение на средния FPG от 23 mg / dL при пациенти, лекувани с Glucophage XR 1000 mg веднъж дневно. Впоследствие дозата за лечение е увеличена до 1500 mg веднъж дневно, ако HbA1c е била ¥ ¥ 7,0%, но <8,0% (пациенти с HbA1c ‰ ¥ 8,0% са прекратени от проучването). При последното посещение (24-седмична) средната стойност на HbA1c е нараснала с 0,2% от изходната стойност при пациенти с плацебо и е намаляла с 0,6% с Glucophage XR.
16-седмично, двойно-сляпо, плацебо-контролирано проучване за отговор на дозата на Glucophage XR, взето веднъж дневно с вечерното хранене или два пъти дневно с хранене, е проведено при пациенти с диабет тип 2, които не са успели да постигнат гликемичен контрол с диета и упражнения (HbA1c 7.0% -11.0%, FPG 126-280 мг / дл). Промените в контрола на гликемията и телесното тегло са показани в таблица 6.
Таблица 6: Обобщение на средните промени от базовата линия * в HbA1в, Плазмена глюкоза на гладно и телесно тегло при последно посещение (16-седмично проучване)
| Глюкофаг XR | Плацебо | |||||
|---|---|---|---|---|---|---|
| 500 mg Веднъж ежедневно |
1000 mg Веднъж ежедневно |
1500 mg Веднъж ежедневно |
2000 mg Веднъж ежедневно |
1000 mg Два пъти ежедневно |
||
| * Всички пациенти на диетична терапия на Baseline | ||||||
| а Всички сравнения с Placebo | ||||||
| ** Не е статистически значима | ||||||
| Хемоглобин А1c (%) | (П = 115) | (П = 115) | (П = 111) | (П = 125) | (П = 112) | (П = 111) |
| Изходна | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Промяна при окончателно посещение | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| р-стойноста | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (П = 126) | (П = 118) | (П = 120) | (П = 132) | (П = 122) | (П = 113) |
| Изходна | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Промяна при окончателно посещение | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| р-стойноста | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Тегло на тялото (фунти) | (П = 125) | (П = 119) | (П = 117) | (П = 131) | (П = 119) | (П = 113) |
| Изходна | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Промяна при окончателно посещение | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| р-стойноста | NS ** | NS ** | NS ** | NS ** | NS ** | - |
В сравнение с плацебо се наблюдава подобрение на гликемичния контрол при всички нива на дозата на Glucophage XR (метформин хидрохлорид) Таблетки с удължено освобождаване и лечението не е свързано със значителна промяна в теглото (виж ДОЗИРОВКА И АДМИНИСТРАЦИЯ за препоръки за дозиране на Glucophage и Glucophage XR).
24-седмично, двойно-сляпо, рандомизирано проучване на Glucophage XR, приемано веднъж дневно с вечерното хранене, и таблетки Glucophage (метформин хидрохлорид), приемани два пъти дневно (с закуска и вечерно хранене), е проведено при пациенти с диабет тип 2, които са били лекувани с Glucophage 500 mg два пъти дневно в продължение на поне 8 седмици преди започване на изследването. Дозата на глюкофага не е задължително да е титрувана, за да се постигне специфично ниво на гликемичен контрол преди влизането в изследването. Пациенти, квалифицирани за изследването, ако HbA1c е ‰ ‰ 8,5%, а FPG е „200 mg / dL. Промените в гликемичния контрол и телесното тегло са показани в таблица 7.
Таблица 7: Обобщение на средните промени от базовата линия * в HbA1в, Плазмена глюкоза на гладно и телесно тегло на 12-та седмица и на последно посещение (24-седмично проучване)
| Glucophage 500 mg Два пъти на ден |
Глюкофаг XR | ||
|---|---|---|---|
| 1000 mg Веднъж дневно |
1500 mg Веднъж дневно |
||
| * Всички пациенти на Glucophage 500 mg два пъти дневно на база | |||
| а п = 68 | |||
| Хемоглобин А1c (%) | (П = 67) | (П = 72) | (П = 66) |
| Изходна | 7.06 | 6.99 | 7.02 |
| Промяна в 12 седмици | 0.14 | 0.23 | 0.04 |
| (95% CI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Промяна при окончателно посещение | 0.14а | 0.27 | 0.13 |
| (95% CI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (П = 69) | (П = 72) | (П = 70) |
| Изходна | 127.2 | 131.0 | 131.4 |
| Промяна в 12 седмици | 12.9 | 9.5 | 3.7 |
| (95% CI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Промяна при окончателно посещение | 14.0 | 11.5 | 7.6 |
| (95% CI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Тегло на тялото (фунти) | (П = 71) | (П = 74) | (П = 71) |
| Изходна | 210.3 | 202.8 | 192.7 |
| Промяна в 12 седмици | 0.4 | 0.9 | 0.7 |
| (95% CI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Промяна при окончателно посещение | 0.9 | 1.1 | 0.9 |
| (95% CI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
След 12 седмици лечение се наблюдава повишаване на средния HbA1в във всички групи; в групата на Glucophage XR 1000 mg, увеличението от изходната стойност от 0,23% е статистически значимо (вж. ДОЗИРОВКА И АДМИНИСТРАЦИЯ).
Промените в липидните параметри в гореописаното проучване на плацебо-контролирана доза-отговор на Glucophage XR са показани в таблица 8.
Таблица 8: Обобщение на промените в средния процент от базовите линии * в основните липидни променливи при окончателно посещение (16-седмично проучване)
| Глюкофаг XR | Плацебо | |||||
|---|---|---|---|---|---|---|
| 500 mg Веднъж ежедневно |
1000 mg Веднъж ежедневно |
1500 mg Веднъж ежедневно |
2000 mg Веднъж ежедневно |
1000 mg Два пъти ежедневно |
||
| * Всички пациенти на диетична терапия на Baseline | ||||||
| Общ холестерол (mg / dL) | (П = 120) | (П = 113) | (П = 110) | (П = 126) | (П = 117) | (П = 110) |
| Изходна | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Средно% промяна при окончателно посещение | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Общи триглицериди (mg / dL) | (П = 120) | (П = 113) | (П = 110) | (П = 126) | (П = 117) | (П = 110) |
| Изходна | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Средно% промяна при окончателно посещение | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-холестерол (mg / dL) | (П = 119) | (П = 113) | (П = 109) | (П = 126) | (П = 117) | (П = 107) |
| Изходна | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Средно% промяна при окончателно посещение | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-холестерол (mg / dL) | (П = 120) | (П = 108) | (П = 108) | (П = 125) | (П = 117) | (П = 108) |
| Изходна | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Средно% промяна при окончателно посещение | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Промените в липидните параметри при описаното по-горе проучване на Glucophage и Glucophage XR са показани в таблица 9.
Таблица 9: Обобщение на промените в средния процент от базовата линия * в основните липидни променливи при окончателно посещение (24-седмично проучване)
| Glucophage | Глюкофаг XR | ||
|---|---|---|---|
| 500 mg Два пъти на ден |
1000 mg Веднъж дневно |
1500 mg Веднъж дневно |
|
| * Всички пациенти на Glucophage 500 mg два пъти дневно на база | |||
| Общ холестерол (mg / dL) | (П = 68) | (П = 70) | (П = 66) |
| Изходна | 199.0 | 201.9 | 201.6 |
| Средно% промяна при окончателно посещение | 0.1% | 1.3% | 0.1% |
| Общи триглицериди (mg / dL) | (П = 68) | (П = 70) | (П = 66) |
| Изходна | 178.0 | 169.2 | 206.8 |
| Средно% промяна при окончателно посещение | 6.3% | 25.3% | 33.4% |
| LDL-холестерол (mg / dL) | (П = 68) | (П = 70) | (П = 66) |
| Изходна | 122.1 | 126.2 | 115.7 |
| Средно% промяна при окончателно посещение | −1.3% | −3.3% | −3.7% |
| HDL-холестерол (mg / dL) | (П = 68) | (П = 70) | (П = 65) |
| Изходна | 41.9 | 41.7 | 44.6 |
| Средно% промяна при окончателно посещение | 4.8% | 1.0% | -2.1% |
Педиатрични клинични изследвания
В двойно сляпо, плацебо-контролирано проучване при педиатрични пациенти на възраст от 10 до 16 години с диабет тип 2 (средно FPG 182,2 mg / dL), лечение с Glucophage (до 2000 г.) mg / ден) до 16 седмици (средна продължителност на лечението 11 седмици) доведе до значително средно нетно намаление на FPG от 64,3 mg / dL в сравнение с плацебо (вж. таблица 10).
Таблица 10: Глюкофаг срещу плацебо (педиатрия)а) Обобщение на средните промени от базовата стойност * в плазмената глюкоза и телесното тегло при окончателно посещение
| Glucophage | Плацебо | р-стойност | |
|---|---|---|---|
| а Педиатрични пациенти средна възраст 13,8 години (диапазон 10-16 години) | |||
| * Всички пациенти на диетична терапия на Baseline | |||
| ** Не е статистически значима | |||
| FPG (mg / dL) | (П = 37) | (П = 36) | |
| Изходна Промяна при окончателно посещение |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Тегло на тялото (фунти) | (П = 39) | (П = 38) | |
| Изходна Промяна при окончателно посещение |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
Горна част
Показания и употреба
Глюкофаг (метформин хидрохлорид) Таблетките са показани като допълнение към диетата и упражненията за подобряване на гликемичния контрол при възрастни и деца със захарен диабет тип 2.
Глюкофаг XR (метформин хидрохлорид) Таблетките с удължено освобождаване са показани като допълнение към диетата и упражненията за подобряване на гликемичния контрол при възрастни със захарен диабет тип 2.
Горна част
Противопоказания
Глюкофагът и Glucophage XR са противопоказани при пациенти с:
Бъбречно заболяване или бъбречна дисфункция (например, както е предложено от нивата на креатинин в серума ¥ [1,5 mg / dL [мъже], ‰ ¥ 1,4 mg / dL [жени] или ненормално креатининов клирънс), който също може да бъде резултат от състояния като сърдечно-съдов колапс (шок), остър миокарден инфаркт и септицемия (виж Предупреждения и МЕРКИ).
Известна свръхчувствителност към метформин хидрохлорид.
Остра или хронична метаболитна ацидоза, включително диабетна кетоацидоза, със или без кома. Диабетна кетоацидоза трябва да се лекува с инсулин.
Глюкофагът и Glucophage XR трябва временно да се преустановят при пациенти, подложени на рентгенологични изследвания, включващи интраваскуларно приложение на йодирани контрастни вещества, тъй като използването на такива продукти може да доведе до остра промяна на бъбречна функция. (Вижте също МЕРКИ.)
Горна част
Предупреждения
Млечна ацидоза:
Млечната ацидоза е рядко, но сериозно метаболитно усложнение, което може да възникне поради натрупване на метформин по време на лечение с Glucophage или Glucophage XR; когато се появи, тя е фатална в приблизително 50% от случаите. Млечната ацидоза също може да се появи във връзка с редица патофизиологични състояния, включително захарен диабет и винаги, когато има значителна тъканна хипоперфузия и хипоксемия. Лактатната ацидоза се характеризира с повишени нива на лактат в кръвта (> 5 mmol / L), понижено pH на кръвта, електролитни нарушения с повишена анионна пропаст и повишено съотношение лактат / пируват. Когато метформин е замесен като причина за лактатна ацидоза, обикновено се откриват плазмени нива на метформин> 5 µg / mL.
Отчетената честота на лактатна ацидоза при пациенти, получаващи метформин хидрохлорид, е много ниска (приблизително 0,03 случая / 1000 пациентски години, с приблизително 0,015 смъртни случая / 1000 пациент-години). При повече от 20 000 пациент-годишни експозиции на метформин в клинични изпитвания няма съобщения за лактатна ацидоза. Съобщаваните случаи са възникнали предимно при пациенти с диабет със значима бъбречна недостатъчност, включително и двата присъщи бъбречни болест и бъбречна хипоперфузия, често при установяване на множество съпътстващи медицински / хирургични проблеми и множество съпътстващи медикаменти. Пациенти с застойна сърдечна недостатъчност, изискващи фармакологично лечение, по-специално тези с нестабилна или остра застойна сърдечна недостатъчност, които са изложени на риск от хипоперфузия и хипоксемия, са изложени на повишен риск от лактация ацидоза. Рискът от лактатна ацидоза се увеличава със степента на бъбречната дисфункция и възрастта на пациента. Следователно рискът от лактатна ацидоза може да бъде значително намален чрез редовен мониторинг на бъбречната функция при пациенти, приемащи Glucophage или Glucophage XR и чрез използване на минималната ефективна доза Glucophage или Glucophage XR. По-специално, лечението на възрастни хора трябва да се придружава от внимателно наблюдение на бъбречната функция. Лечението с глюкофаг или Glucophage XR не трябва да се започва при пациенти на възраст 80 години, освен ако не се измерва креатинин клирънсът показва, че бъбречната функция не се намалява, тъй като тези пациенти са по-податливи на развитие на лактат ацидоза. В допълнение, Glucophage и Glucophage XR трябва незабавно да бъдат отказани при наличие на някакво състояние, свързано с хипоксемия, дехидратация или сепсис. Тъй като нарушената чернодробна функция може значително да ограничи способността за изчистване на лактата, глюкофага и Обикновено глюкофаг XR трябва да се избягва при пациенти с клинични или лабораторни данни за чернодробни заболяване. Пациентите трябва да бъдат предупредени срещу прекомерния прием на алкохол, или остър, или хроничен, когато приемат Глюкофаг или Glucophage XR, тъй като алкохолът усилва ефекта на метформин хидрохлорид върху лактат метаболизъм. В допълнение, Glucophage и Glucophage XR трябва временно да бъдат прекратени преди всяко интраваскуларно радиоконтрастно изследване и за всяка хирургична процедура (вижте също МЕРКИ).
Началото на лактатната ацидоза често е фино и е придружено само от неспецифични симптоми като неразположение, миалгии, дихателни дистрес, увеличаваща се сънливост и неспецифичен коремен дистрес. Може да има свързана хипотермия, хипотония и резистентни брадиаритмии с по-изразена ацидоза. Пациентът и лекарят на пациента трябва да са наясно с възможната важност на такива симптоми и пациентът трябва да бъде инструктиран да уведоми незабавно лекаря, ако се появят (виж също МЕРКИ). Глюкофагът и Glucophage XR трябва да бъдат оттеглени до изясняване на ситуацията. Серумните електролити, кетони, кръвна глюкоза и ако е посочено, pH на кръвта, нива на лактат и дори нивата на метформин в кръвта могат да бъдат полезни. След като пациентът е стабилизиран на нивото на дозата на Glucophage или Glucophage XR, стомашно-чревните симптоми, които са чести по време на започване на терапия, е малко вероятно да са свързани с лекарството. По-късното възникване на стомашно-чревни симптоми може да се дължи на лактатна ацидоза или друго сериозно заболяване.
Нивата на венозен плазмен лактат на гладно над горната граница на нормата, но по-малко от 5 mmol / L при пациенти, приемащи Glucophage или Glucophage XR, не означават непременно предстояща лактатна ацидоза и може да се обясни с други механизми, като лошо контролиран диабет или затлъстяване, енергична физическа активност или технически проблеми в пробата работа. (Вижте също МЕРКИ.)
Млечна ацидоза трябва да се подозира при всеки пациент с диабет с метаболитна ацидоза, липсваща доказателства за кетоацидоза (кетонурия и кетонемия).
Млечната ацидоза е медицинска спешност, която трябва да се лекува в болнична обстановка. При пациент с лактатна ацидоза, който приема Glucophage или Glucophage XR, лекарството трябва незабавно да бъде прекратено и незабавно да се приложат общи поддържащи мерки. Тъй като метформин хидрохлорид може да се диализира (с клирънс до 170 мл / мин при добра хемодинамика състояния), препоръчва се бърза хемодиализа за коригиране на ацидозата и отстраняване на натрупаната метформин. Такова управление често води до бързо обръщане на симптомите и възстановяване. (Вижте също ПРОТИВОПОКАЗАНИЯ и МЕРКИ.)
Горна част
предпазни мерки
Общ
Макроваскуларни резултати - Няма клинични проучвания, установяващи категорични доказателства за намаляване на макроваскуларния риск с Glucophage или Glucophage XR или друго антидиабетно лекарство.
Мониторинг на бъбречната функция - Известно е, че метформин се отделя значително от бъбреците и рискът от натрупване на метформин и млечна ацидоза нараства със степента на увреждане на бъбреците функция. По този начин, пациентите със серумни нива на креатинин над горната граница на нормата за тяхната възраст не трябва да получават Glucophage или Glucophage XR. При пациенти в напреднала възраст Glucophage и Glucophage XR трябва да бъдат внимателно титрирани, за да се установят минималната доза за адекватен гликемичен ефект, тъй като стареенето е свързано с намалена бъбречна функция функция. При пациенти в напреднала възраст, особено тези на възраст 80 години, бъбречната функция трябва да се следи редовно и като цяло Glucophage и Glucophage XR не трябва да бъдат титрирани до максималната доза (вж. Предупреждения и ДОЗИРОВКА И АДМИНИСТРАЦИЯ).
Преди започване на терапия с Glucophage или Glucophage XR и поне веднъж годишно след това бъбречната функция трябва да бъде оценена и проверена като нормална. При пациенти, при които се очаква развитие на бъбречна дисфункция, трябва да се направи оценка на бъбречната функция по-често и Glucophage или Glucophage XR се преустановяват, ако има данни за бъбречно увреждане настояще.
Използване на съпътстващи лекарства, които могат да повлияят на бъбречната функция или разположението на метформин - Съпътстващи лекарства (и), които могат да повлияят на бъбречната функция или да доведат до значителна хемодинамична промяна или може да пречи на разположението на метформин, като катионни лекарства, които се елиминират чрез бъбречна тубулна секреция (вж. МЕРКИ: Лекарствени взаимодействия), трябва да се използва с повишено внимание.
Рентгенологични изследвания, включващи използването на интраваскуларни йодирани контрастни материали (например, венозна урограма, интравенозно холангиография, ангиография и компютърна томография (КТ) с интраваскуларни контрастни материали) - Интраваскуларни контрастни изследвания с йодираните материали могат да доведат до остра промяна на бъбречната функция и са свързани с лактатна ацидоза при пациенти, получаващи метформин (виж ПРОТИВОПОКАЗАНИЯ). Следователно, при пациенти, при които се планира такова изследване, Glucophage или Glucophage XR трябва да бъдат временно преустановени по време на или преди процедура и се задържа за 48 часа след процедурата и се възстановява само след като бъбречната функция е преоценена и е установено, че е нормалното.
Хипоксични състояния - сърдечно-съдов колапс (шок) от каквато и да е причина, остра застойна сърдечна недостатъчност, остър миокард инфаркт и други състояния, характеризиращи се с хипоксемия, са свързани с лактатна ацидоза и могат също да причинят преренална азотемия. Когато се появят подобни събития при пациенти на терапия с Glucophage или Glucophage XR, лекарството трябва незабавно да бъде прекратено.
Хирургични процедури - Глюкофажът или Glucophage XR терапия трябва да бъдат временно преустановени за всяка хирургична процедура (с изключение на незначителни процедури, които не са свързани с ограничен прием на храна и течности) и не трябва да се рестартира, докато пероралният прием на пациента не се възобнови и бъбречната функция не бъде оценена като нормалното.
Прием на алкохол - Известно е, че алкохолът усилва ефекта на метформин върху метаболизма на лактата. Следователно пациентите трябва да бъдат предупредени срещу прекомерен прием на алкохол, остър или хроничен, докато получават Glucophage или Glucophage XR.
Нарушена чернодробна функция - Тъй като нарушената чернодробна функция е свързана с някои случаи на лактатна ацидоза, Глюкофагът и Glucophage XR обикновено трябва да се избягват при пациенти с клинични или лабораторни данни за чернодробни заболяване.
Нива на витамин B12 - при контролирани клинични изпитвания на Glucophage с продължителност 29 седмици, намаляване до субнормални нива на преди нормални серумни нива на витамин В12, без клинични прояви, са наблюдавани при приблизително 7% от пациенти. Подобно намаление, вероятно поради смущение в абсорбцията на В12 от комплекса на В12-присъщия фактор, обаче е много рядко е свързана с анемия и изглежда бързо обратима с прекратяване на Глюкофаг или витамин В12 добавки. Ежегодно се препоръчва измерване на хематологични параметри при пациенти на Glucophage или Glucophage XR и всички видими аномалии трябва да бъдат подходящо изследвани и управлявани (вж. МЕРКИ: Лабораторни тестове).
Определени хора (тези с недостатъчен прием на витамин В12 или прием на калций или усвояване) изглежда са предразположени към развитие на субнормални нива на витамин В12. При тези пациенти може да са полезни рутинните измервания на серумния витамин В12 на интервали от 2 до 3 години.
Промяна в клиничния статус на пациенти с по-рано контролиран диабет тип 2 - Пациент с диабет тип 2, който преди това е бил добре контролиран на Glucophage или Glucophage XR, които развива лабораторни аномалии или клинични заболявания (особено неясни и лошо дефинирани заболявания) трябва да бъдат оценени своевременно за данни за кетоацидоза или лактация ацидоза. Оценката трябва да включва нивата на серумните електролити и кетони, кръвната глюкоза и, ако е посочено, нивото на pH на кръвта, лактат, пируват и метформин. При поява на ацидоза в която и да е форма, Glucophage или Glucophage XR трябва незабавно да бъдат спрени и да се предприемат други подходящи коригиращи мерки (виж също Предупреждения).
Хипогликемия - хипогликемия не се наблюдава при пациенти, получаващи само глюкофаж или глюкофаг XR при обичайни обстоятелства на употреба, но може да възникне, когато приемът на калории е дефицит, когато усиленото упражнение не се компенсира с добавяне на калории или по време на едновременна употреба с други средства за понижаване на глюкозата (като сулфонилуреи и инсулин) или етанол.
Пациенти в напреднала възраст, инвалидизирани или недохранени и такива с надбъбречна или хипофизна недостатъчност или алкохолна интоксикация са особено податливи на хипогликемични ефекти. Хипогликемията може да бъде трудно разпознаваема при възрастни хора и при хора, които приемат блокиращи бета-адренергични лекарства.
Загуба на контрол на кръвната глюкоза - Когато пациентът, стабилизиран на който и да е диабетичен режим, е изложен на стрес като треска, травма, инфекция или операция, може да настъпи временна загуба на гликемичен контрол. В такива моменти може да се наложи отказване на глюкофаг или глюкофаг XR и временно прилагане на инсулин. Глюкофагът или Glucophage XR могат да бъдат възстановени след решаване на острия епизод.
Ефективността на пероралните антидиабетни лекарства за понижаване на кръвната глюкоза до целево ниво намалява при много пациенти за определен период от време. Това явление, което може да се дължи на прогресиране на основното заболяване или на намалена реакция на лекарството, е известна като вторична недостатъчност, за да се разграничи от първичната недостатъчност, при която лекарството е неефективно по време на първоначалната терапия. Ако възникне вторична недостатъчност или с монотерапия с Glucophage, или с Glucophage XR или със сулфонилурея, комбинираната терапия с Glucophage или Glucophage XR и сулфонилурея може да доведе до отговор. Ако се появи вторична недостатъчност при комбинирана терапия с глюкофаг / сулфонилурея или глюкофаг XR / сулфонилурея терапия, може да се наложи да се обмислят терапевтични алтернативи, включително започване на инсулинова терапия.
Информация за пациенти
Пациентите трябва да бъдат информирани за потенциалните рискове и ползи от Glucophage или Glucophage XR и за алтернативните методи на лечение. Те също трябва да бъдат информирани за важността на спазването на диетични инструкции, на редовно упражнение програма и редовно тестване на кръвна глюкоза, гликозилиран хемоглобин, бъбречна функция и хематологични параметри.
Рисковете от лактатна ацидоза, нейните симптоми и състояния, предразполагащи към нейното развитие, както е отбелязано в Предупреждения и МЕРКИ секции, трябва да бъдат обяснени на пациентите. Пациентите трябва да бъдат посъветвани незабавно да преустановят приема на Glucophage или Glucophage XR и незабавно да уведомят за здравето си практикуващ, ако необяснима хипервентилация, миалгия, неразположение, необичайна сънливост или други неспецифични симптоми възникне. След като пациентът е стабилизиран на някакво ниво на дозата на Glucophage или Glucophage XR, стомашно-чревните симптоми, които са често срещани по време на започване на терапия с метформин, е малко вероятно да са свързани с лекарството. По-късното възникване на стомашно-чревни симптоми може да се дължи на лактатна ацидоза или друго сериозно заболяване.
Пациентите трябва да бъдат съветвани срещу прекомерния прием на алкохол, остър или хроничен, докато получават Glucophage или Glucophage XR.
Самият глюкофаг или Glucophage XR обикновено не причинява хипогликемия, въпреки че може да възникне, когато Glucophage или Glucophage XR се използват заедно с орални сулфонилуреи и инсулин. При започване на комбинирана терапия, рисковете от хипогликемия, нейните симптоми и лечение и условията, които предразполагат към неговото развитие, трябва да бъдат обяснени на пациентите и отговорното семейство членове.
Пациентите трябва да бъдат информирани, че Glucophage XR трябва да се поглъща цели, а не да се смачква или дъвче, и че неактивните съставки могат от време на време да се елиминират в изпражненията като мека маса, която може да наподобява оригинала таблетка.
Лабораторни тестове
Реакцията на всички терапии за диабет трябва да се следи чрез периодични измервания на кръвта на гладно нива на глюкоза и гликозилиран хемоглобин, с цел да се намалят тези нива към нормалните диапазон. По време на началното титруване на дозата глюкозата на гладно може да се използва за определяне на терапевтичния отговор. След това трябва да се следи както глюкозата, така и гликозилираният хемоглобин. Измерванията на гликозилиран хемоглобин могат да бъдат особено полезни за оценка на дългосрочен контрол (виж също ДОЗИРОВКА И АДМИНИСТРАЦИЯ).
Първоначално и периодично проследяване на хематологичните параметри (напр. Хемоглобин / хематокрит и червена кръв клетъчни индекси) и бъбречната функция (серумен креатинин) трябва да се извършват, поне на годишна база. Докато рядко е наблюдавана мегалобластиканемия при терапия с Глюкофаж, ако се подозира, дефицитът на витамин В12 трябва да бъде изключен.
Лекарствени взаимодействия (клинична оценка на лекарствените взаимодействия, проведени с глюкофаж)
Glyburide - В проучване за взаимодействие с една доза при пациенти с диабет тип 2, съвместно приложение на метформин и глибурид не доведоха до промени във фармакокинетиката на метформина или фармакодинамика. Наблюдавани са понижения на AUC и Cmax на глибурид, но са силно променливи. Естествената доза на това проучване и липсата на корелация между нивата на глибурид в кръвта и фармакодинамичните ефекти, правят клиничното значение на това взаимодействие несигурно (вж. ДОЗИРОВКА И АДМИНИСТРАЦИЯ: Съпътстваща глюкофаг или глюкофаг XR и орална сулфонилурея терапия при възрастни пациенти).
Фуроземид - Изследване за взаимодействие с лекарства с еднократна доза метформин-фуроземид при здрави индивиди показа, че фармакокинетичните параметри на двете съединения са повлияни от едновременното приложение. Фуроземид повишава плазмата на метформина и Cmax в кръвта с 22%, а AUC в кръвта - с 15%, без значителна промяна в бъбречния клирънс на метформина. Когато се прилагат с метформин, Cmax и AUC на фуроземид са съответно 31% и 12% по-малки, отколкото когато приложен самостоятелно и крайният полуживот е намален с 32%, без значителна промяна в фуроземид бъбрек клирънс. Няма налична информация за взаимодействието на метформин и фуросемид, когато се прилага едновременно хронично.
Нифедипин - Проучване за взаимодействие с лекарства с еднократна доза метформин-нифедипин при нормални здрави доброволци показа, че едновременното приложение на нифедипин повишава плазмения метформин Cmax и AUC съответно с 20% и 9% и увеличава количеството екскретира се с урината. Tmax и полуживотът не са засегнати. Изглежда, че нифедипин засилва абсорбцията на метформин. Метформинът имаше минимални ефекти върху нифедипин.
Катионни лекарства - катионни лекарства (напр. Амилорид, дигоксин, морфин, прокаинамид, хинидин, хинин, ранитидин, триамтерен, триметоприм или ванкомицин), които се елиминират чрез бъбречна тубулна секреция теоретично имат потенциал за взаимодействие с метформин, като се състезават за общ бъбречен тубуларен транспорт системи. Такова взаимодействие между метформин и перорален циметидин е наблюдавано при нормални здрави доброволци както с еднократна, така и с многократна доза метформин-циметидин проучвания за лекарствени взаимодействия, с 60% увеличение на пиковите плазмени концентрации на метформин и пълна кръв и 40% увеличение на метформин в плазма и пълна кръв AUC. Няма промени в елиминационния полуживот в проучването с еднократна доза. Метформин няма ефект върху фармакокинетиката на циметидин. Въпреки че подобни взаимодействия остават теоретични (с изключение на циметидин), внимателното наблюдение на пациента и коригиране на дозата на Glucophage или Glucophage XR и / или интерфериращото лекарство се препоръчва при пациенти, които приемат катионни лекарства, които се екскретират чрез проксималната бъбречна тубуларна секретория система.
Други - Някои лекарства са склонни да произвеждат хипергликемия и могат да доведат до загуба на гликемичен контрол. Тези лекарства включват тиазидите и други диуретици, кортикостероиди, фенотиазини, продукти на щитовидната жлеза, естрогени, орални контрацептиви, фенитоин, никотинова киселина, симпатомиметици, лекарства, блокиращи калциевите канали, и изониазид. Когато такива лекарства се прилагат на пациент, приемащ Glucophage или Glucophage XR, пациентът трябва да бъде внимателно наблюдаван за загуба на контрол на кръвната захар. Когато такива лекарства се оттеглят от пациент, който получава Глюкофаг или Glucophage XR, пациентът трябва да се наблюдава отблизо за хипогликемия.
При здрави доброволци фармакокинетиката на метформин и пропранолол и метформин и ибупрофен не се повлиява, когато се прилага едновременно в проучвания за взаимодействие с една доза.
Метформинът е незначително свързан с плазмените протеини и следователно е по-малко вероятно да взаимодейства с лекарства, силно свързани с протеини, като напр. салицилати, сулфонамиди, хлорамфеникол и пробенецид в сравнение със сулфонилуреите, които са силно свързани със серума протеини.
Канцерогенеза, мутагенеза, увреждане на плодовитостта
Проведени са дългосрочни проучвания за канцерогенност при плъхове (продължителност на дозировката 104 седмици) и мишки (продължителност на дозата 91 седмици) при дози до и включително 900 mg / kg / ден и 1500 mg / kg / ден, съответно. И двете дози са приблизително 4 пъти над максималната препоръчителна дневна доза за човек от 2000 mg въз основа на сравненията на телесната повърхност. Не са открити данни за канцерогенност с метформин нито при мъжки, нито при женски мишки. По подобен начин не е наблюдаван туморогенен потенциал с метформин при мъжки плъхове. Има обаче повишена честота на доброкачествени стромални маточни полипи при женски плъхове, лекувани с 900 mg / kg / ден.
Няма данни за мутагенен потенциал на метформин при следните ин витро тестове: Еймсов тест (S. тифимуриум), тест за генна мутация (клетки на миши лимфоми) или тест за хромозомни аберации (човешки лимфоцити). Резултатите от in vivo тест за микронуклеус на мишка също бяха отрицателни.
Фертилитетът на мъжки или женски плъхове не се повлиява от метформин, когато се прилага в дози до 600 mg / kg / ден, което е приблизително 3 пъти максималната препоръчителна дневна доза при хора въз основа на телесната повърхност сравнения.
бременност
Тератогенни ефекти: категория Бременност
Последната информация категорично подсказва, че анормалните нива на кръвна захар по време на бременност са свързани с по-висока честота на вродени аномалии. Повечето експерти препоръчват инсулин да се използва по време на бременност, за да се поддържа нивото на кръвната захар възможно най-близко до нормалното. Тъй като проучванията върху репродукцията на животни не винаги предсказват човешки отговор, Glucophage и Glucophage XR не трябва да се използват по време на бременност, освен ако не е ясно необходимо.
Няма адекватни и добре контролирани проучвания при бременни жени с Glucophage или Glucophage XR. Метформинът не е тератогенен при плъхове и зайци в дози до 600 mg / kg / ден. Това представлява експозиция от около 2 и 6 пъти максималната препоръчителна дневна доза за човека от 2000 mg въз основа на сравненията на телесната повърхност съответно за плъхове и зайци. Определянето на феталните концентрации показа частична плацентарна бариера пред метформина.
Кърмещи майки
Проучвания при кърмещи плъхове показват, че метформин се отделя в мляко и достига нива, сравними с тези в плазмата. Подобни проучвания не са провеждани при кърмачки. Тъй като потенциалът за хипогликемия при кърмачета може да съществува, трябва да се вземе решение дали да преустановете кърменето или да прекратите приема на лекарството, като вземете предвид значението на лекарството за майка. Ако Glucophage или Glucophage XR се преустановят и ако диетата сама по себе си не е достатъчна за контролиране на кръвната глюкоза, трябва да се обмисли терапия с инсулин.
Педиатрична употреба
Безопасността и ефективността на Glucophage за лечение на диабет тип 2 са установени през педиатрични пациенти на възраст от 10 до 16 години (проучвания не са провеждани при педиатрични пациенти на възраст под 10 години години). Използването на Glucophage в тази възрастова група се подкрепя от доказателства от адекватни и добре контролирани проучвания на Glucophage при възрастни с допълнителни данни от контролирано клинично проучване при педиатрични пациенти на възраст от 10 до 16 години с диабет тип 2, което демонстрира сходен отговор в гликемичния контрол на този, наблюдаван при възрастни. (Виж КЛИНИЧНА ФАРМАКОЛОГИЯ: Педиатрични клинични изследвания.) В това проучване нежеланите реакции са били подобни на тези, описани при възрастни. (Виж НЕЖЕЛАНИ РЕАКЦИИ: Педиатрични пациенти.) Препоръчва се максимална дневна доза от 2000 mg. (Виж ДОЗИРОВКА И АДМИНИСТРАЦИЯ: Препоръчителна схема на дозиране: Педиатрия.)
Безопасността и ефективността на Glucophage XR при педиатрични пациенти не са установени.
Гериатрична употреба
Контролираните клинични проучвания на Glucophage и Glucophage XR не включват достатъчен брой пациенти в напреднала възраст, за да се определи дали те отговарят различно от по-младите пациенти, въпреки че други съобщени клинични опит не са установили разлики в отговорите между възрастни и по-млади пациенти. Известно е, че метформин се отделя значително от бъбреците и защото рискът от сериозни нежелани реакции към лекарството е по-голям при пациенти с нарушена бъбречна функция, Glucophage и Glucophage XR трябва да се използват само при пациенти с нормална бъбречна функция (вж. ПРОТИВОПОКАЗАНИЯ, Предупреждения, и КЛИНИЧНА ФАРМАКОЛОГИЯ: Фармакокинетика). Тъй като стареенето е свързано с намалена бъбречна функция, Glucophage или Glucophage XR трябва да се използват с повишено внимание, тъй като възрастта се увеличава. Трябва да се внимава при подбора на дозата и трябва да се основава на внимателен и редовен мониторинг на бъбречната функция. Обикновено пациентите в напреднала възраст не трябва да бъдат титрирани до максималната доза Glucophage или Glucophage XR (виж също Предупреждения и ДОЗИРОВКА И АДМИНИСТРАЦИЯ).
Горна част
Нежелани реакции
В американско двойно сляпо клинично проучване на Glucophage при пациенти с диабет тип 2, общо 141 пациенти са получавали терапия с глюкофаг (до 2550 mg на ден), а 145 пациенти са получавали плацебо. Нежеланите реакции, съобщени при повече от 5% от пациентите с Glucophage и които са по-чести при пациенти, лекувани с Glucophage, отколкото плацебо, са изброени в Таблица 11.
Таблица 11: Най-чести нежелани реакции (> 5,0 процента) при плацебо-контролирано клинично проучване на глюкофаговата монотерапия *
| Нежелана реакция | Glucophage Монотерапия (П = 141) |
Плацебо (П = 145) |
|---|---|---|
| % от пациентите | ||
| * Реакции, които са по-чести при пациенти, лекувани с глюкофаги, отколкото плацебо. | ||
| диария | 53.2 | 11.7 |
| Гадене / повръщане | 25.5 | 8.3 |
| метеоризъм | 12.1 | 5.5 |
| астения | 9.2 | 5.5 |
| стомашно разстройство | 7.1 | 4.1 |
| Коремен дискомфорт | 6.4 | 4.8 |
| главоболие | 5.7 | 4.8 |
Диарията доведе до прекратяване на изследваното лекарство при 6% от пациентите, лекувани с Glucophage. Допълнително са съобщени следните нежелани реакции при ¥ ¥ 1,0% до ¤ .0 5,0% от пациентите с Glucophage и по-често се съобщават за Glucophage, отколкото плацебо: ненормални изпражнения, хипогликемия, миалгия, главоболие, задух, нарушение на ноктите, обрив, повишено изпотяване, разстройство на вкуса, дискомфорт в гърдите, втрисане, грипен синдром, зачервяване, сърцебиене.
В световните клинични проучвания над 900 пациенти с диабет тип 2 са били лекувани с Glucophage XR в плацебо- и активно контролирани проучвания. В плацебо-контролирани проучвания, 781 пациенти са били прилагани Glucophage XR, а 195 пациенти са получавали плацебо. Нежеланите реакции, съобщени при повече от 5% от пациентите с Glucophage XR и които са по-чести при пациенти с Glucophage XR, отколкото плацебо, са изброени в таблица 12.
Таблица 12: Най-честите нежелани реакции (> 5,0 процента) при плацебо-контролирани изследвания на глюкофаг XR *
| Нежелана реакция | Глюкофаг XR (П = 781) |
Плацебо (П = 195) |
|---|---|---|
| % от пациентите | ||
| * Реакции, които са по-чести при пациенти с Glucophage XR, отколкото при пациенти, лекувани с плацебо. | ||
| диария | 9.6 | 2.6 |
| Гадене / повръщане | 6.5 | 1.5 |
Диарията доведе до прекратяване на изследваното лекарство при 0,6% от пациентите, лекувани с Glucophage XR. Освен това са докладвани следните нежелани реакции при â ¥ 1,0% до ¤ .0 5,0% от пациентите с Glucophage XR и по-често се съобщават при Glucophage XR от плацебо: коремна болка, запек, дистантна корема, диспепсия / киселини, метеоризъм, замаяност, главоболие, инфекция на горните дихателни пътища, вкус смущения.
Педиатрични пациенти
В клинични проучвания с Glucophage при педиатрични пациенти с диабет тип 2, профилът на нежеланите реакции е подобен на този, наблюдаван при възрастни.
Горна част
свръх доза
Настъпило е предозиране на метформин хидрохлорид, включително поглъщане на количества над 50 грама. Хипогликемия се съобщава в приблизително 10% от случаите, но не е установена причинно-следствена връзка с метформин хидрохлорид. Съобщава се за лактатна ацидоза в приблизително 32% от случаите на предозиране с метформин (вж Предупреждения). Метформинът може да се диализира с клирънс до 170 mL / min при добри хемодинамични условия. Следователно хемодиализата може да бъде полезна за отстраняване на натрупаното лекарство от пациенти, при които се подозира предозиране на метформин.
Горна част
Дозировка и приложение
Няма фиксиран режим на дозиране за лечение на хипергликемия при пациенти с диабет тип 2 с Glucophage или Glucophage XR или друг фармакологичен агент. Дозировката на Glucophage или Glucophage XR трябва да бъде индивидуализирана въз основа както на ефективността, така и на поносимостта, като не надвишава максималните препоръчителни дневни дози. Максималната препоръчителна дневна доза Glucophage е 2550 mg при възрастни и 2000 mg при педиатрични пациенти (на възраст 10-16 години); максималната препоръчителна дневна доза Glucophage XR при възрастни е 2000 mg.
Глюкофагът трябва да се прилага в разделени дози заедно с храненето, докато Glucophage XR обикновено трябва да се прилага веднъж дневно с вечерното хранене. Glucophage или Glucophage XR трябва да се започне с ниска доза, с постепенно повишаване на дозата, и двете, за да се намали стомашно-чревни странични ефекти и да се позволи идентифициране на минималната доза, необходима за адекватен гликемичен контрол на пациента.
По време на започване на лечението и титриране на дозата (вж. Препоръчителната схема за дозиране по-долу) трябва да бъде плазмена глюкоза на гладно използва се за определяне на терапевтичния отговор на Glucophage или Glucophage XR и идентифициране на минималната ефективна доза за търпелив. След това трябва да се измерва гликозилиран хемоглобин на интервали приблизително 3 месеца. Терапевтичната цел трябва да бъде да намали нивата на плазмената глюкоза на гладно и гликозилирания хемоглобин до нормални или близки до нормалните стойности използване на най-ниската ефективна доза Glucophage или Glucophage XR, или когато се използва като монотерапия или в комбинация със сулфонилурея или инсулин.
Мониторингът на кръвната глюкоза и гликозилирания хемоглобин също ще позволи откриване на първична недостатъчност, т.е. недостатъчно понижаване на кръвната глюкоза при максимална препоръчителна доза лекарства и вторична недостатъчност, т.е. загуба на адекватен отговор за понижаване на кръвната захар след първоначален период от ефикасност.
Краткотрайното приложение на Glucophage или Glucophage XR може да бъде достатъчно по време на периоди на преходна загуба на контрол при пациенти, които обикновено са добре контролирани само при диета.
Glucophage XR таблетки трябва да се поглъщат цели и никога да не се смачкват или дъвчат. Понякога неактивните съставки на Glucophage XR ще бъдат елиминирани в изпражненията като мека, хидратирана маса.
Препоръчителна схема на дозиране
Възрастни
По принцип клинично значимите отговори не се наблюдават при дози под 1500 mg на ден. Въпреки това се препоръчва по-ниска препоръчителна начална доза и постепенно увеличена доза, за да се сведат до минимум стомашно-чревните симптоми.
Обичайната начална доза Glucophage (метформин хидрохлорид) таблетки е 500 mg два пъти на ден или 850 mg веднъж дневно, дадени с храна. Увеличаването на дозата трябва да се извършва на стъпки от 500 mg седмично или 850 mg на всеки 2 седмици, до общо 2000 mg на ден, дадени в разделени дози. Пациентите могат също да бъдат титрирани от 500 mg два пъти дневно до 850 mg два пъти дневно след 2 седмици. За тези пациенти, които се нуждаят от допълнителен гликемичен контрол, може да се прилага глюкофаг до максимална дневна доза от 2550 mg на ден. Дози над 2000 mg могат да се понасят по-добре, като се дават 3 пъти на ден по време на хранене.
Обичайната начална доза на Glucophage XR (метформин хидрохлорид) таблетки с удължено освобождаване е 500 mg веднъж дневно с вечерното хранене. Увеличаването на дозата трябва да се извършва на стъпки от 500 mg седмично, до максимум 2000 mg веднъж дневно с вечерното хранене. Ако не се постигне гликемичен контрол върху Glucophage XR 2000 mg веднъж дневно, трябва да се обмисли проучване на Glucophage XR 1000 mg два пъти дневно. Ако са необходими по-високи дози метформин, трябва да се използва Glucophage в общи дневни дози до 2550 mg, приложени в разделени дневни дози, както е описано по-горе. (Виж КЛИНИЧНА ФАРМАКОЛОГИЯ: Клинични изследвания.)
В рандомизирано проучване пациентите, които понастоящем се лекуват с Glucophage, преминават към Glucophage XR. Резултатите от това проучване предполагат, че пациентите, които получават лечение с глюкофаг, могат безопасно да преминат към Glucophage XR веднъж дневно при една и съща обща дневна доза, до 2000 mg веднъж дневно. След преминаване от Glucophage към Glucophage XR, гликемичният контрол трябва да се следи отблизо и съответно да се коригират дозата (вж. КЛИНИЧНА ФАРМАКОЛОГИЯ: Клинични изследвания).
педиатрия
Обичайната начална доза на Glucophage е 500 mg два пъти на ден, дава се заедно с храна. Увеличаването на дозата трябва да се извършва на стъпки от 500 mg седмично до максимум 2000 mg на ден, дадени в разделени дози. Безопасността и ефективността на Glucophage XR при педиатрични пациенти не са установени.
Трансфер от друга антидиабетна терапия
При прехвърляне на пациенти от стандартни перорални хипогликемични средства, различни от хлорпропамид, към Glucophage или Glucophage XR, обикновено не е необходим преходен период. При прехвърляне на пациенти от хлорпропамид трябва да се внимава през първите 2 седмици поради продължително задържане на хлорпропамид в организма, което води до припокриващи се лекарствени ефекти и евентуална хипогликемия.
Едновременна терапия с глюкофаж или глюкофаж XR и орална сулфонилурея при възрастни пациенти
Ако пациентите не са отговорили на 4 седмици от максималната доза монотерапия с Glucophage или Glucophage XR, трябва да се обмисли постепенното добавяне на перорална сулфонилурея при продължаване на Glucophage или Glucophage XR в максималната доза, дори ако преди първична или вторична недостатъчност на сулфонилурея има настъпили. Клинични и фармакокинетични данни за лекарствени взаимодействия понастоящем са налични само за метформин плюс глибурид (глибенкламид).
С едновременна терапия с глюкофаж или глюкофаж XR и сулфонилурея, желаният контрол на кръвната глюкоза може да се постигне чрез коригиране на дозата на всяко лекарство. В клинично изпитване на пациенти с диабет тип 2 и предшестваща недостатъчност на глибурид, пациентите, започващи с Glucophage 500 mg, а глибурид 20 mg са титрирани до 1000/20 mg, 1500/20 mg, 2000/20 mg или 2500/20 mg от Glucophage и глибурид, съответно, за постигане на целта на гликемичния контрол, измерен чрез FPG, HbA1c и плазмен глюкозен отговор (виж КЛИНИЧНА ФАРМАКОЛОГИЯ: Клинични изследвания). Трябва обаче да се направят опити за определяне на минималната ефективна доза на всяко лекарство за постигане на тази цел. При едновременната терапия с глюкофаж или глюкофаж XR и сулфонилурея, рискът от хипогликемия, свързана със терапията със сулфонилурея, продължава и може да се увеличи. Трябва да се вземат подходящи предпазни мерки. (Вижте вложката за опаковката на съответната сулфонилурея.)
Ако пациентите не са отговорили задоволително на 1 до 3 месеца съпътстваща терапия с максималната доза Glucophage или Glucophage XR и максимална доза перорална сулфонилурея, помислете за терапевтични алтернативи, включително преминаване към инсулин със или без Glucophage или Glucophage XR.
Съпътстваща глюкофаг или глюкофаг XR и инсулинова терапия при възрастни пациенти
Настоящата доза инсулин трябва да продължи след започване на терапията с Glucophage или Glucophage XR. Лечението с глюкофаг или Glucophage XR трябва да се започне с 500 mg веднъж дневно при пациенти на инсулинова терапия. За пациенти, които не реагират адекватно, дозата на Glucophage или Glucophage XR трябва да се увеличи с 500 mg след приблизително 1 седмица и по 500 mg всяка седмица след това, докато не бъде осигурен адекватен гликемичен контрол постигнати. Максималната препоръчителна дневна доза е 2500 mg за Glucophage и 2000 mg за Glucophage XR. Препоръчва се при плазмена глюкоза на гладно дозата инсулин да бъде намалена с 10% до 25% концентрациите намаляват до по-малко от 120 mg / dL при пациенти, получаващи съпътстващ инсулин и глюкофаг или Глюкофаг XR. По-нататъшната корекция трябва да бъде индивидуализирана въз основа на отговора за понижаване на глюкозата.
Специфични популации на пациентите
Глюкофаг или Glucophage XR не се препоръчват за употреба при бременност. Глюкофагът не се препоръчва при пациенти на възраст под 10 години. Глюкофаг XR не се препоръчва при педиатрични пациенти (на възраст под 17 години).
Първоначалното и поддържащо дозиране на Glucophage или Glucophage XR трябва да бъде консервативно при пациенти в напреднала възраст, поради потенциала за намаляване на бъбречната функция при тази популация. Всяка корекция на дозата трябва да се основава на внимателна оценка на бъбречната функция. Като цяло пациентите в напреднала възраст, изтощените и недохранени не трябва да бъдат титрирани до максималната доза Glucophage или Glucophage XR.
Наблюдението на бъбречната функция е необходимо за подпомагане на профилактиката на лактатна ацидоза, особено при възрастни хора. (Виж Предупреждения.)
Горна част
Как се доставя
Glucophage® (метформин хидрохлорид) таблетки
| 500 mg | Бутилки от 100 | NDC 0087-6060-05 |
| 500 mg | Бутилки от 500 | NDC 0087-6060-10 |
| 850 mg | Бутилки от 100 | NDC 0087-6070-05 |
| 1000 mg | Бутилки от 100 | NDC 0087-6071-11 |
Глюкофаж 500 mg таблетки са кръгли, бели до почти бели, филмирани таблетки, вдлъбнати с "BMS 6060 "около периферията на таблета от едната страна и" 500 "вдлъбнато върху лицето на другата страна.
Glucophage 850 mg таблетки са кръгли, бели до почти бели, филмирани таблетки, вдлъбнати с "BMS 6070 "около периферията на таблета от едната страна и" 850 "вдлъбнато върху лицето на другата страна.
Таблетките Glucophage 1000 mg са бели, овални, двойно изпъкнали, филмирани таблетки с "BMS 6071" с вдлъбнато покритие от едната страна и "1000" с вдлъбнатина от обратната страна и с бисектна линия от двете страни.
Glucophage® XR (метформин хидрохлорид) таблетки с удължено освобождаване
| 500 mg | Бутилки от 100 | NDC 0087-6063-13 |
| 750 mg | Бутилки от 100 | NDC 0087-6064-13 |
Glucophage XR 500 mg таблетки са бели до почти бели, капсулова форма, двойно изпъкнали таблетки, с надпис "BMS 6063" от едната страна и "500" вдлъбнато върху лицето на другата страна.
Glucophage XR 750 mg таблетки са капсулова форма, двойно изпъкнали таблетки, с "BMS 6064" с вдлъбнатина от едната страна и "750" с релефна от другата страна. Таблетките са бледочервени и могат да имат петна.
съхранение
Да се съхранява при 20 ° -25 ° C (68 ° -77 ° F); разрешени екскурзии до 15 ° -30 ° C (59 ° -86 ° F). [Вижте USP контролирана стайна температура.]
Разпределете в устойчиви на светлина съдове.
Glucophage® е регистрирана търговска марка на Merck Santà © S.A.S., сътрудник на Merck KGaA от Дармщат, Германия. Лицензиран за Bristol-Myers Squibb Company.
Разпространено от:
Bristol-Myers Squibb Company
Принстън, NJ 08543 САЩ
последна актуализация: 01/2009
Глюкогаж, метформин хидрохлорид, информация за пациента (на обикновен английски)
Подробна информация за признаците, симптомите, причините, лечението на диабета
Информацията в тази монография не е предназначена да обхване всички възможни употреби, указания, предпазни мерки, лекарствени взаимодействия или нежелани ефекти. Тази информация е обобщена и не е предназначена за конкретни медицински съвети. Ако имате въпроси относно лекарствата, които приемате или искате повече информация, консултирайте се с Вашия лекар, фармацевт или медицинска сестра.
обратно към: Прегледайте всички лекарства за диабет



